
【题目】三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________。滤渣1的主要成分为______________(填化学式)。
(2)酸浸时双氧水的作用有___________。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2,污染境,该反应的离子方程式为__________。

(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH。则放电时正极的电极反应式为__________。
NiOOH+MH。则放电时正极的电极反应式为__________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
【答案】增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分 MnO2 亚铁离子氧化为铁离子 Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O 分液漏斗、烧杯 NiOOH+e-+H+= Ni(OH)2 2 Co2++HCO3-+3NH3H2O= Co2(OH)2CO3+3NH4++H2O 2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O
2Co2O3+2CO2+2H2O
【解析】
含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3;先把原料进行酸浸,MnO2与稀硫酸不反应,成为滤渣;滤液中含有Co2+、Co3+、Ni2+、Fe2+、Fe3+等离子;调整溶液的pH,铁离子生成沉淀滤出;再把滤液进行萃取,含有Ni2+的物质进入有机相,水溶液中含有Co2+,然后加入碳酸氢铵和氨水,反应生成Co2(OH)2CO3,然后煅烧生成Co2O3,据以上分析进行解答。
(1)研磨的目的是增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分;根据流程可知,铁离子变为氢氧化铁,镍离子进入有机相,水溶液中含有Co2+,经过一系列过程,最后得到氧化钴,所以滤渣1的主要成分为MnO2;综上所述,本题答案是:增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分;MnO2。
(2)酸浸时,加入双氧水能够把亚铁离子氧化为铁离子;Co2O3与盐酸发生氧化还原反应生成Cl2,Co Cl2和水,该反应的离子方程式为:Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O;综上所述,本题答案是:亚铁离子氧化为铁离子;Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O。
(3)在实验室里,萃取操作要用到的玻璃仪器主要有分液漏斗、烧杯;电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH,放电时正极发生还原反应,所以正极的电极反应式为:NiOOH+e-+H+= Ni(OH)2;综上所述,本题答案是:分液漏斗、烧杯;NiOOH+e-+H+= Ni(OH)2。
NiOOH+MH,放电时正极发生还原反应,所以正极的电极反应式为:NiOOH+e-+H+= Ni(OH)2;综上所述,本题答案是:分液漏斗、烧杯;NiOOH+e-+H+= Ni(OH)2。
(4)根据流程可知:含有Co2+离子的溶液中加入碳酸氢铵和氨水,反应生成Co2(OH)2CO3;沉钴时发生反应的离子方程式为:2 Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;在空气中煅烧Co2(OH)2CO3,反应生成Co2O3和CO2,化学方程式为:2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O;综上所述,本题答案是:2Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;2Co2(OH)2CO3+O2
2Co2O3+2CO2+2H2O;综上所述,本题答案是:2Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O 。
2Co2O3+2CO2+2H2O 。


科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50 mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,实验测得加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如下图所示。下列叙述正确的是

A. HA溶液的物质的量浓度为0.01 mol·L-1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离常数K约为1.25×10-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,E的元素符号为___________
(2)A、B两种元素可形成化学式为B2A、B2A2等化合物,则B2A2的电子式为_____。
(3)将B2A2投入到B2D的水溶液中可生成D的单质,发生反应的离子方程式为:______________________
(4)DA2与E元素的单质在水中反应的离子方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为___________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_______________。
(5)GaAs的熔点为1238℃,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。
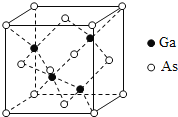
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正硫的是
A. 硫化钠的水解反应:S2-+H3O+![]() HS-+H2O
HS-+H2O
B. 用铜做阳极电解氯化铜溶液:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
C. 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O
D. 泡沫灭火器工作时化学反应:2Al3++3CO32-+6H2O=Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国发射宇宙飞船的 “神舟”系列火箭用偏二甲肼(C2H8N2)作燃料,液态四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式: _______________________________。
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量________(填“大于”、“小于”或“等于”)生成物的总能量,断开化学键________的总能量________(填“大于”、“小于”或“等于”)形成化学键________的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
选项 | 单质 | 酸碱 | 碱 | 胶体 |
A | 水银 | 硝酸 | 纯碱 | 蛋白质溶液 |
B | 溴水 | 硫酸 | 烧碱 | 烟 |
C | C60 | 醋酸 | 熟石灰 | 雾 |
D | 臭氧 | 碳酸 | 氢氧化铜 | 氢氧化铁沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3
C. 明矾水解生成Al(OH)胶体,可用作净水剂
D. 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com