
【题目】(1)同主族的A、B两元素,已知A的原子序数为x,A和B所在周期包含元素的种数分别为m和n,如果A和B在第ⅠA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________;如果A和B在第ⅦA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________。
(2)已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是(____)
A.n=m+1 B.n=m+10 C.n=m+11 D.n=m+25
【答案】 x-n x+m x-m x+n B
【解析】
(1)A、B同在ⅠA族,当B在A的上一周期时,B和A的原子序数之差恰好为B所在周期的元素种类数,则B的原子序数为![]() ;当B在A的下一周期时,A和B的原子序数之差恰好为A所在周期的元素种类数,则B的原子序数为
;当B在A的下一周期时,A和B的原子序数之差恰好为A所在周期的元素种类数,则B的原子序数为![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ,
,![]() ;
;
A、B同在ⅦA族时,A、B原子序数之差恰好为相邻两周期下一周期的元素种类数,与A、B同在ⅠA族相反,如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为![]() ,当B在A的下一周期时,B的原子序数为
,当B在A的下一周期时,B的原子序数为![]() .因此,本题正确答案是:
.因此,本题正确答案是:![]() ,
,![]()
(2)A.若为短周期,ⅡA族元素、ⅢA族元素的原子序数相差1,则![]() ,所以A选项是正确的;B.无论元素在短周期还是长周期,都不存在
,所以A选项是正确的;B.无论元素在短周期还是长周期,都不存在![]() ,故B错误;C.若元素在四、五周期,中间有10个纵行,ⅡA族元素、ⅢA族元素的原子序数相差11,即
,故B错误;C.若元素在四、五周期,中间有10个纵行,ⅡA族元素、ⅢA族元素的原子序数相差11,即![]() ,所以C选项是正确的;D.若元素在五、六周期,中间有10个纵行,且存在镧系(14种元素)和锕系,ⅡA族元素、ⅢA族元素的原子序数相差25,即
,所以C选项是正确的;D.若元素在五、六周期,中间有10个纵行,且存在镧系(14种元素)和锕系,ⅡA族元素、ⅢA族元素的原子序数相差25,即![]() ,所以D选项是正确的;
,所以D选项是正确的;
所以B选项是正确的


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】MgO、Al2O3都是常用的耐火材料,某研究小组取100 kg含60%Al的报废汽车的镁合金材料来制备MgO、Al2O3,其中物质甲可由溶液B转化再生,其工艺流程如图所示。
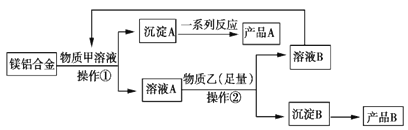
请回答下列问题:
(1)下列说法正确的是__________(填字母)。
A.合金是金属与金属熔合而成的混合物
B.合金的熔点比成分金属更高
C.合金的硬度等机械性能优于成分金属
D.氧化铝熔点高,故可以用氧化铝坩埚熔融氢氧化钠
(2)物质甲是________________,产品A是________________。
(3)操作②为____________。
(4)足量物质乙与溶液A发生反应的离子方程式为___________________________。
(5)假设不计损耗,可得产品B的质量为__________kg。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 加压有利于SO2与O2反应生成SO3 B. 500度左右比常温下更有利于合成氨
C. 将氨气液化,有利于合成氨的反应 D. 用过量空气煅烧硫铁矿可以提高原料利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,原子半径依次增大。W、X在同一主族,Y元素在第三周期中离子半径最小,Y和Z的原子序数之和是W的3倍。下列说法正确的是
A. X的简单氢化物的热稳定性比W的强 B. X的氧化物对应的水化物是强酸
C. Z和W形成的化合物可能含有非极性键 D. Z、Y的氧化物是常用的耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是 ( )
A. 盐酸溶液加到氢氧化铁中:Fe(OH)3+3H+===Fe3++3H2O
B. 硫酸与氢氧化钡溶液反应:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
C. CuSO4溶液与氨水反应:Cu2++2NH3·H2O===Cu(OH)2↓+2NH。
D. 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金、银、铜、铁、铝和钛均是人类大量生产和使用的金属。试回答与上述金属原子结构有关的问题:
(1)上述金属中属于主族元素的有________。
(2)钛被称为继铁、铝之后的第三金属。基态钛原子外围电子的电子排布图为_____________。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中位于第_____周期第____族。
(4)已知Ag与Cu位于同一族,则Ag在元素周期表中位于________区(填“s”、“p”、“d”、“f”或“ds”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述中,说法正确的是
A. 钠在空气中燃烧,产物是Na2O
B. 钠投入氯化铁溶液中出现红褐色沉淀
C. 钠是银白色金属,硬度大,熔点高
D. 钠与水反应生成O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com