
【题目】化学与生命活动密切相关。以下是人体中血红蛋白、肌红蛋白与O2结合机制的相关研究,假定其环境温度均为36.8℃。
(1)血红蛋白Hb结合O2形成动脉血,存在反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O
HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O![]() H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
(2)肌肉中大量肌红蛋白 Mb也可结合O2形成MbO2,即反应③:Mb(aq)+O2(g)![]() MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=![]() 。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,
。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,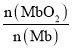 =4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
=4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
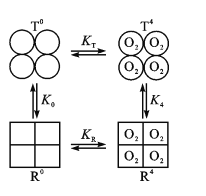
(3)Hb分子具有四个亚基,且每个亚基有两种构型(T型和R型)。图中,T0、R0表示未结合O2的T型和R型,且存在可逆的变构效应:T0![]() R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4
R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4![]() R4也是变构效应,正向平衡常数为K4。
R4也是变构效应,正向平衡常数为K4。
①已知某肺炎病人肺脏中T0+4O2![]() T4反应的n(O2)数据如下:
T4反应的n(O2)数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(O2)/10-6 mol | 1.68 | 1.64 | 1.58 | 1.50 | 1.40 |
计算2.0 min~8.0 min内以T的物质的量变化表示的反应速率v(T4)为_________mol·min-1。
②现假定R型Hb对O2的结合常数为KR,T型Hb对O2的结合常数为KT。已知KR>KT,则图中K0____K4(填“>”或“<”)。
(4)氧气是生命活动必不可少的物质。如下图所示,以Pt为阳极,Pb(CO2)的载体,使CO2活化为阴极,电解经CO2饱和处理的KHCO3溶液可使氧气再生,同时得到甲醇。其阴极反应式为____;从电解后溶液中分离甲醇的操作方法是_______________。

【答案】< 较高 增大氧分压,反应①正向移动,产生较高浓度的H+,从而反应②平衡逆向移动 不变 98% 1.0×10-8 < 7CO2+6e-+5H2O=CH3OH+6HCO3- 减压蒸馏
【解析】
(1)根据反应自发进行的依据判断;根据平衡移动原理分析判断;
(2)化学平衡常数只与温度有关,温度不变,化学平衡常数不变;根据化学平衡常数与O2的结合度的关系计算;
(3)①先计算氧气变化的物质的量,然后根据反应中氧气与T4的量变化关系,计算用T表示的反应速率v(T4);
②根据物质转化关系,分别用K0、K4、KT、KR表示,结合KR>KT,推导K0、K4的大小关系;
(4)在阴极上CO2得到电子,变为CH3OH及HCO3-,据此书写电极反应式;根据甲醇熔沸点低分析判断分离方法。
(1)对于反应HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq),△S<0,若该反应可自发进行,则根据反应自发进行的判断依据△G=△H-T△S<0,所以ΔH<0;根据反应①:HbH+(aq)+O2(g)
HbO2(aq)+H+(aq),△S<0,若该反应可自发进行,则根据反应自发进行的判断依据△G=△H-T△S<0,所以ΔH<0;根据反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)可知:增大氧分压,反应①正向移动,产生较高浓度的H+,H+浓度增大,反应②:CO2+H2O
HbO2(aq)+H+(aq)可知:增大氧分压,反应①正向移动,产生较高浓度的H+,H+浓度增大,反应②:CO2+H2O![]() H++HCO3-的平衡逆向移动,从而可降低血液中CO2的浓度,有利于将CO2排出体外;
H++HCO3-的平衡逆向移动,从而可降低血液中CO2的浓度,有利于将CO2排出体外;
(2)由于只增大氧气的分压,温度不变,化学平衡常数只与温度有关,温度不变,则化学平衡常数K不变;在氧分压p(O2)=2.00 kPa 的平衡体系中,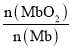 =4.0,则该温度下该反应的化学平衡常数K=
=4.0,则该温度下该反应的化学平衡常数K=![]() =2.0,温度不变,吸入的空气中p(O2)=21 kPa,假设此时 Mb与氧气的最大结合度为x,则由于化学平衡常数K=
=2.0,温度不变,吸入的空气中p(O2)=21 kPa,假设此时 Mb与氧气的最大结合度为x,则由于化学平衡常数K=![]() ,则x=
,则x=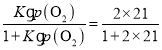 =98%;
=98%;
(3)根据表格数据可知在2.0 min~8.0 min内O2的物质的量变化了△n(O2)=(1.64 -1.40)×10-6 mol=2.4×10-7mol,则根据O2与T4变化的物质的量的比是4:1,所△n(T4)=![]() △n(O2)=6.0×10-8 mol,所以以T变化表示的反应速率v(T4)=6.0×10-8 mol÷6 min=1.0×10-8 mol/min;
△n(O2)=6.0×10-8 mol,所以以T变化表示的反应速率v(T4)=6.0×10-8 mol÷6 min=1.0×10-8 mol/min;
②根据物质转化关系可知:K0=![]() ,K4=
,K4=![]() ,KT=
,KT=![]() ,KR=
,KR=![]() ,由于KR>KT,则
,由于KR>KT,则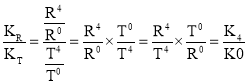 >1,所以K4>K0,即K0<K4;
>1,所以K4>K0,即K0<K4;
(4)CO2中C元素化合价为+4价,在阴极上CO2得到电子,变为CH3OH中C的-2价,同时产生HCO3-,则阳极的电极反应式为:7CO2+6e-+5H2O=CH3OH+6HCO3-;阳极上水电离产生的OH-失去电子变为O2,因此可使氧气再生;由于甲醇属于分子晶体,物质的熔沸点比较低,而NaHCO3熔沸点高,减小压强,物质的熔沸点会降低,因此从电解后溶液中分离甲醇的操作方法是减压蒸馏法。


科目:高中化学 来源: 题型:
【题目】为测定二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,摩尔质量用M表示)样品的纯度,将mg样品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气,用V1mLc1molL1稀硫酸充分吸收,吸收后的溶液用c2molL1NaOH中和,平均消耗NaOH溶液的体积为V2mL。
(1)该样品中[Co(NH3)5Cl]Cl2的纯度为___;
(2)写出简要计算过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要漂白剂,实验室可按下图装置制取NaClO2晶体。

已知:Ⅰ.A中发生的反应为:2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O
Ⅱ.NaClO2受热易分解,温度高于60℃时分解成NaClO3和NaCl。
(1)已知ClO2与Cl2类似具有漂白性,请设计检验ClO2漂白性的实验方案______。
(2)A中用冰水浴的目的是______。
(3)装置B的作用是______。
(4)测定样品中NaClO2的质量分数的实验过程如下:
步骤一:称0.5000 g样品,加入适量蒸馏水和过量的KI晶体和硫酸,发生如下反应:ClO![]() +4I﹣+4H+=2H2O+2I2+Cl﹣
+4I﹣+4H+=2H2O+2I2+Cl﹣
步骤二:将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液作指示剂,用0.2000 mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为15.00 mL(滴定过程中发生反应:I2+2S2O32-=2I﹣+S4O62-)。
①配制100 mL 0.2000 mol·L-1Na2S2O3标准溶液需要用到的玻璃仪器有烧杯、胶头滴管、______。
②请计算所称取样品中NaClO2的质量分数_______________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜矾(主要成分 CuSO4·5H2O)是一种可用于食品添加的铜强化剂。现以某硫铁矿渣(含有 CuSO4、CuSO3、Cu2O及少量难溶于酸的Cu2S、CuS)制备铜矾的工艺过程如下:
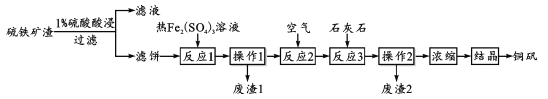
(1)“1%硫酸酸浸”时,固液质量比为1:3并进行4~6次浸取,其目的是_________;
(2)“滤饼”中含有Cu,其中Cu在“反应1”中溶解的离子方程式为________;“废渣1”中只含有S单质,则“反应1”中Cu2S与Fe2(SO4)3反应的物质的量之比为_______。
(3)“反应2”中通入空气的目的是_______;结合离子方程式,说明“反应3”加入石灰石的作用________。
(4)为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前进行的必要操作是_____;分析下列溶解度信息,最适宜的结晶方式为_________。
t/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 |
CuSO4·5H2O/(g/100g H2O) | 23.1 | 27.5 | 32.0 | 37.8 | 44.6 | 61.8 | 83.8 |
(5)将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,其有效成分为CuSO4·xCu(OH)2·yCa(OH)2。当x=1时,试确定y的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案合理的是________
A.配制银氨溶液:在一定量![]() 溶液中,滴加氨水至沉淀恰好溶解
溶液中,滴加氨水至沉淀恰好溶解
B.检验RX中的卤素原子,把RX与烧碱水溶液混合加热后,将溶液冷却再加入硝酸银溶液
C.无水乙醇和浓硫酸共热至170℃,将制得的气体通入酸性高锰酸钾溶液,可检验制得的气体是否为乙烯
D.实验室制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度
E.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
F.用氨水清洗做过银镜反应的试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法不正确的是
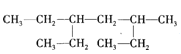
A.该有机物属于饱和链烃
B.该烃的名称是2,4-二乙基己烷
C.该烃与2,5-二甲基-3-乙基己烷互为同分异构体
D.该烃的一氯代物共有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧磷酸亚铁锂正极材料(主要成分为LiFePO4,含炭黑、铝等杂质)为原料可制备LiOH溶液和FePO4。
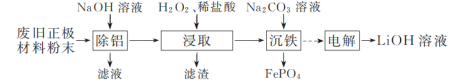
(1)“除铝”时反应的离子方程式为______________________________。
(2)试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:______。
(3)“浸取”所得滤液中,磷元素的存在形式主要是________(填字母)。
a. PO![]() b. H3PO4 c. H2PO
b. H3PO4 c. H2PO![]()
(4)“沉铁”时铁、磷的沉淀率随溶液pH的变化如图1所示。pH>2.5后磷元素的沉淀率逐渐下降,原因是_____________________。
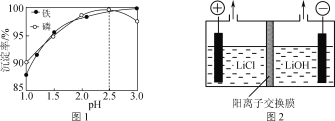
(5)“电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是________________________________________。
(6)LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是
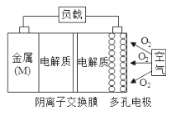
A.该电池的正极反应方程式为O2+4e-+2H2O=4OH-
B.为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C.该电池中电子从金属电极流出,流经电解质到多孔电极
D.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成在化工医药领域应用广泛,下图是一种新型药物合成路线。
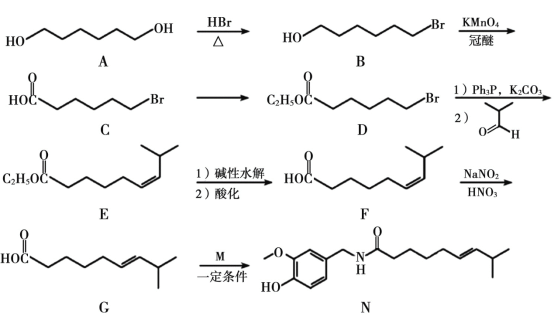
回答下列问题:
(1)A 的系统命名法(CCS)名称为________,D 中官能团的名称为________。
(2)B→C 的反应类型为________,从反应所得液态有机混合物中提纯 B 的常用方法为________。
(3)C→D 的化学方程式为________。C 和 D 在下列哪种检测仪上显示出的信号峰是完全相同的_________
A.元素分析仪 b.红外光谱仪 c.核磁共振仪 d.质谱仪
(4)C 的同分异构体 W(不考虑手性异构)可发生银镜反应,且 1 mol W 最多与 2 molNaOH 发生反应,产物之一可被氧化成二元醛,满足上述条件的 W 有________种。若 W 的核磁共振氢谱具有四组峰,则其结构简式为________。
(5)F 与 G 的关系为(填序号)________。
A.碳链异构 b.官能团类别异构 c.顺反异构 d.官能团位置异构
(6)M 的结构简式为________。
(7)参照上述合成路线,以![]() 和
和![]() 为原料制备医药中间体
为原料制备医药中间体![]() ,写出合成路线流程图_________________________________________________________________。
,写出合成路线流程图_________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com