
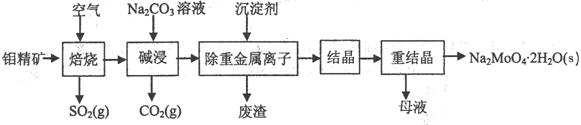
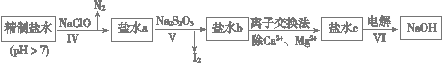
 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________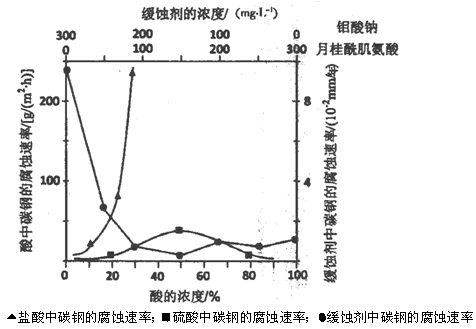
 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:问答题
| ||
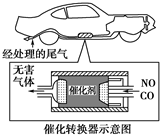
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )A.若某温度下,反应后 =11,则溶液中 =11,则溶液中 = = |
| B.参加反应的氯气的物质的量等于0.5amol |
C.改变温度,反应中转移电子的物质的量ne的范围: amol≤ne≤ amol≤ne≤ amol amol |
D.改变温度,产物中KC1O3的最大理论产量为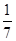 amol amol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
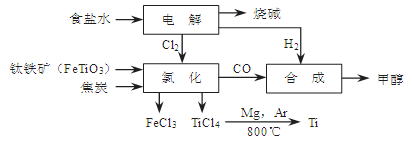
 CH3OH(g)。
CH3OH(g)。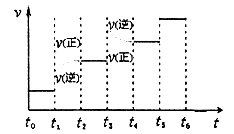
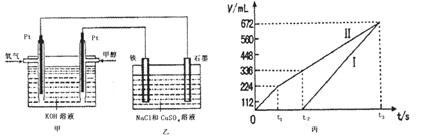
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2仅作还原剂,硫元素被氧化 |
| C.每生成1molCu2S,有4mol硫被氧化 |
| D.每转移l.2 mol电子,有0.2mo!硫被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8:11 | B.3:5 | C.1:2 | D.9:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com