
科目:高中化学 来源: 题型:
 →
→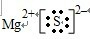
 →
→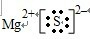
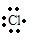 +Ca2++
+Ca2++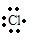 →
→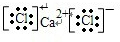
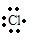 +Ca2++
+Ca2++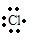 →
→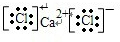
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若 XY2是离子化合物,则 X 与 Y 的原子序数不可能相差 8 | B、若 XY2是共价化合物,则 X 与 Y 的原子序数不可能相差 1 | C、若 X 与 Y 的原子序数相差 5,则离子化合物 XY2不溶于水 | D、若 X 与 Y 的原子序数相差 6,则共价化合物 XY2不溶于强碱溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com