
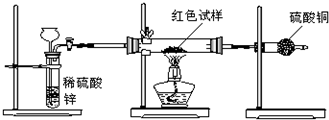
| 10 |
| 9 |
| 10 |
| 9 |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:0117 期末题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:浙江 题型:问答题
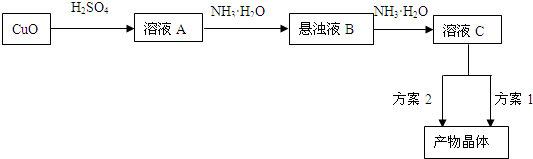


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
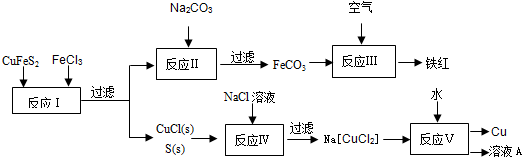
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制取相同量的硝酸铜需硝酸的量③最多 |
| B.制取相同量的硝酸铜①产生的有毒气体比②多 |
| C.三种方案中硝酸的利用率③>①>② |
| D.三种方案的反应都可以在铁制容器中进行 |
查看答案和解析>>
科目:高中化学 来源:山东 题型:问答题
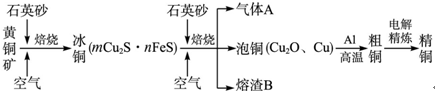
查看答案和解析>>
科目:高中化学 来源:朝阳区一模 题型:填空题
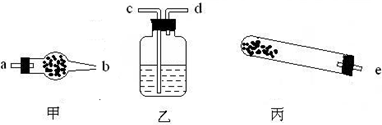
| 仪器 | 试管 | ______ | ______ |
| 药品 | 碱式碳酸铜 | ______ | ______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
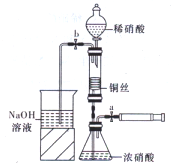
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com