
【题目】![]() 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:![]() 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为![]() 。
。
回答下列问题:
(1)![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子(
,净产生的中子(![]() )数为________。基态
)数为________。基态![]() 原子的外围电子排布式为
原子的外围电子排布式为![]() ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)![]() 和
和![]() 中,沸点较高的为________,与
中,沸点较高的为________,与![]() 形成的配离子稳定性较高的为________。
形成的配离子稳定性较高的为________。
(3)![]() 中存在大
中存在大![]() 键,形成该大
键,形成该大![]() 键的电子数为________。
键的电子数为________。
(4)某种铀氮化物的晶体结构与![]() 相同。
相同。![]() 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
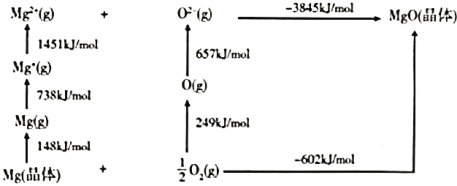
①![]() 晶格能为________
晶格能为________![]() 。
。
②![]() 的第二电离能大于
的第二电离能大于![]() 的第二电离能,是由于
的第二电离能,是由于![]() 的半径较
的半径较![]() 小、
小、![]() 的核电荷更高以及_______。
的核电荷更高以及_______。
(5)另一种铀氮化物的晶胞如下图所示,![]() “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
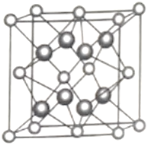
①铀元素的化合价为________,![]() “原子”的配位数为________。
“原子”的配位数为________。
②已知晶胞参数为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)。
(列出计算式)。
【答案】![]() B
B ![]()
![]() 6 3845
6 3845 ![]() 为
为![]() 相对稳定结构,破坏需要额外提供能量
相对稳定结构,破坏需要额外提供能量 ![]() 8
8 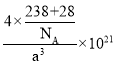
【解析】
根据裂变反应:![]() 中净产生的中子(
中净产生的中子(![]() )数和
)数和![]() 的物质的量判断;核外电子排布轨道处于半充满和全充满时相对稳定;根据电离能的递变性和变化规律判断;根据晶胞结构分析晶体的化学式并进行相关计算。
的物质的量判断;核外电子排布轨道处于半充满和全充满时相对稳定;根据电离能的递变性和变化规律判断;根据晶胞结构分析晶体的化学式并进行相关计算。
(1)![]() 的物质的量为1mol,根据裂变反应:
的物质的量为1mol,根据裂变反应:![]() ,可知净产生的中子(
,可知净产生的中子(![]() )的物质的量为2mol,数目为2NA;基态U原子的外围电子排布式为5f36d17s2,
)的物质的量为2mol,数目为2NA;基态U原子的外围电子排布式为5f36d17s2,![]() 、
、![]() 和
和![]() 均为其基态原子的激发态,
均为其基态原子的激发态,![]() 为U+,由第二电离明显高于第一电离可知,
为U+,由第二电离明显高于第一电离可知,![]() 再失去1个电子所需要的能量最高,故答案为B;
再失去1个电子所需要的能量最高,故答案为B;
(2)NH3常温下为气态,而H2O常温下为液态,则沸点较高的为H2O;NH3结合质子的能力强于H2O,则NH3与Cu2+形成的配离子稳定性强于H2O与Cu2+形成的配离子稳定性;
(3)CO32-中存在大π键,C原子孤对电子数为![]() =0,则其路易斯结构式为
=0,则其路易斯结构式为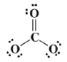 ,形成的大π键为
,形成的大π键为![]() ,该大π键的电子数为6;
,该大π键的电子数为6;
(4)①MgO的晶格能为Mg2+(g)和O2-(g)生成MgO(s)放出的能量,则MgO的晶格能为3845kJmol-1;
②
(5)另一种铀氮化物的晶胞是U“原子”作面心立方最密堆积,其中含有U的原子数目为8×![]() +6×
+6×![]() =4,N原子数为8,其化学式为UN2;
=4,N原子数为8,其化学式为UN2;
①晶胞化学式为UN2,其中N为-3价,则铀元素的化合价为+6价;晶胞中顶点U原子最靠近的N原子数是1,顶点U为8个晶胞共用,则U原子的配位数为8;
②已知晶胞参数为anm,晶胞的体积为(a×10-7cm)3,晶胞的质量为![]() g,则晶体的密度为
g,则晶体的密度为![]() =
=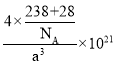 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
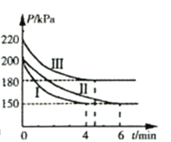
【题目】工业上用CO2和NH3合成尿素 [CO(NH2)2]。某研发小组为合成尿素进行如下实验:向5L恒容密闭容器中通入0.2molNH3和0.1molCO2,分别进行Ⅰ、Ⅱ、Ⅲ三组实验。在不同条件下发生反应:![]() ,反应体系总压强随时间的变化曲线如图所示。
,反应体系总压强随时间的变化曲线如图所示。
(1)已知:
①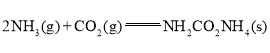
![]()
②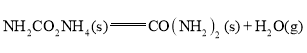
![]()
用CO2和NH3合成尿素的热化学方程式为________。
(2)Ⅰ、Ⅱ、Ⅲ三组实验中,反应温度最高的是________。(填“Ⅰ”、“Ⅱ”或“Ⅲ”)
(3)Ⅰ、Ⅲ两组实验中,NH3转化率较高的是________。(填“Ⅰ”或“Ⅲ”)
(4)若要增加实验Ⅱ的反应速率并提高NH3转化率,改变下列条件可以实现的是________(填标号)
A.增加CO2的物质的量 B.加入惰性气体使压强增大
C.升高反应的温度 D.改用2L的容器进行实验
(5)Ⅰ、Ⅱ两组实验中,反应达到平衡的时间不同,可能的原因是________。
(6)第Ⅱ组实验开始6min内NH3的平均反应速率为________![]() ,平衡常数
,平衡常数![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.20 mol NO和0.20 mol CO混合气体充入容积为2.0 L的恒容密闭容器中,分别在T1和T2温度下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应过程中容器内CO2的物质的量随时间变化关系如图所示,下列说法正确的是
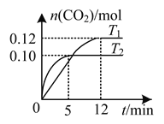
A.T1<T2
B.容器内气体的密度不再改变时反应到达平衡
C.T2温度下,该反应的平衡常数K=10
D.T1温度时,前12 min的平均反应速率v(CO)=0.01 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是探究温度对化学反应速率的影响的实验,其中三支试管中均为3 mL滴有FeCl3溶液的5% H2O2溶液(如下图所示)。
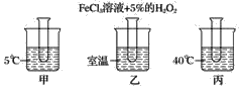
(1)三支试管内溶液产生氧气气泡速率由大到小为________。
(2)由上述实验可得出的结论为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氨柔比星是临床主要用于治疗癌症的药物。F是合成盐酸氨柔比星的三种中间体之一,其合成路线如下:

⑴化合物D的分子式为C12H14O2,请写出D的结构简式:______。
⑵写出同时满足下列条件的B的一种同分异构体的结构简式:_____。
Ⅰ.能发生银镜反应,且能与FeCl3溶液发生显色反应;
Ⅱ.分子中含有4种不同化学环境的氢。
⑶请写出以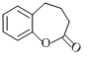 为原料制备
为原料制备![]() 的合成路线(无机试剂任选)。合成路线流程例见本题题干。____________________
的合成路线(无机试剂任选)。合成路线流程例见本题题干。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究在常温下氢氧化钡晶体与氯化铵晶体反应过程中能量变化的实验方案和实验步骤如图所示,根据下面的实验方案和步骤回答下列问题:

下表是某学生根据上述实验方案和步骤列表整理的实验事实和结论:
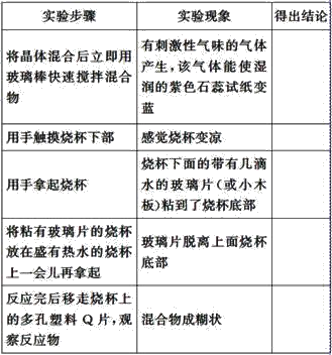
(1)请你根据实验现象得出相应的实验结论填入上表中。_________________。
(2)用化学方程式表示上述反应为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是
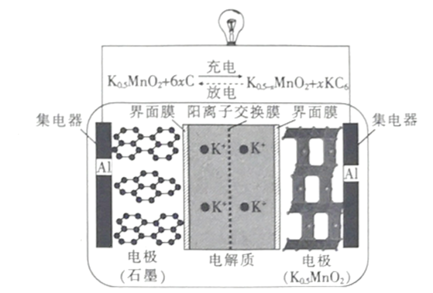
A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某课外活动小组在进行探究乙醇性质实验时遇到的问题,请你帮助解决。
(1)在做乙醇与钠反应的实验时,把一小块钠缓慢放入装有乙醇的试管内,与钠和水反应相比有所不同:①钠没有熔化成小球;②钠先沉在试管底;③反应后逐渐浮起。小组同学进行讨论,前两点现象解释达成共识。请说出你的看法:
①钠没有熔化成小球是因为_________________;
②钠先沉在试管底是因为__________________;
③第三点现象解释存在争议,活动小组的同学形成两种意见:a生成的氢气产生浮力所致;b生成的乙醇钠增大了溶液的密度所致。请你设计一个实验验证a和b说法的合理_________
(2)在做乙醇的催化氧化实验中,某同学有个意外发现:在酒精灯外焰上灼烧铜丝观察到铜丝表面变黑;当铜丝接近灯芯,变黑的铜丝又恢复原来的红色。请用化学方程式解释上述变化的过程_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com