
| A. | ①④⑦⑧ | B. | ③④⑦⑧ | C. | ②⑤⑧⑨ | D. | ④⑦⑧⑨ |
分析 非金属原子间主要形成共价键,但稀有气体中无化学键,只含有共价键的化合物属于共价化合物;阴阳离子间形成离子键,含有离子键的化合物一定是离子化合物,但离子化合物中也可能含有共价键,在熔融状态下能导电的化合物一定属于离子化合物;化学反应一定有旧键的断裂和新键的形成,据此回答.
解答 解:①非金属元素构成的单质中不一定存在共价键,如稀有气体,故错误;
②非金属之间形成的化合物不一定是共价化合物,如氯化铵属于离子化合物,故错误;
③化学键断裂过程中,不一定发生了化学变化,如氯化氢溶于水,故错误;
④晶体中含有阴离子,一定含有阳离子;晶体中含有阳离子,不一定有阴离子,正确;
⑤金属元素和非金属元素形成的化合物不一定是离子化合物,如氯化铝属于共价化合物,故错误;
⑥在一种化合物中可能存在2种类型的化学键,如氯化铵中含有离子键和共价键,故错误;
⑦含共价键的化合物不一定是共价化合物,如氯化铵中含有共价键,但属于离子化合物,故错误;
⑧含离子键的化合物一定是离子化合物,正确;
⑨在熔化状态下能否导电的化合物一定属于离子化合物,故正确.
故选D.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,注意不能根据是否含有金属元素判断离子键,采用举例法分析解答.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LN2中含有π健数为3NA | |
| B. | 12g金刚石中含有C-C键数为4NA | |
| C. | 25℃时,pH=12的CH3COONa溶液中水电离出的OH-的数目为0.01NA | |
| D. | 当反应3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O生成89.6L标准状况的气体时,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氯气溶于水:Cl2+H2O?2H++Cl一+ClO一 | |
| C. | 过量二氧化碳与石灰水反应:CO2+2OH一=CO32一+H2O | |
| D. | 利用腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C60与14C60互为同位素 | |
| B. | 14C转变为12C的过程属于化学变化 | |
| C. | 12C与14C的原子中含有的中子数之比为3:4 | |
| D. | 金刚石与C60都属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ⑨ |
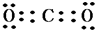 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程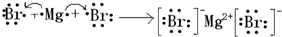
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
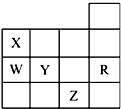 如图为元素周期表前四周期的一部分,下列 有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列 有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )| A. | 常压下5种元素的单质中Z单质的沸 点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | W的氢化物的还原性比Y的氢化物的还原性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.06mol/(L•min) | B. | 0.075mol/(L•min) | C. | 0.09mol/(L•min) | D. | 0.12mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com