
【题目】下列关于物质的用途及反应方程式的叙述不正确的是( )
A.印刷电路板时用FeCl3作为腐蚀液:2Fe3+ + Cu == 2Fe2+ + Cu2+
B.用HF雕刻玻璃:SiO2 + 4HF == SiF4↑ + 2H2O
C.高炉炼铁的主要原理:CO + FeO == Fe + CO2
D.小苏打做发酵粉:2NaHCO3 == Na2CO3 + H2O + CO2↑
【答案】C
【解析】
A. 制作印刷电路板时用FeCl3作为腐蚀液,氯化铁和铜反应生成氯化亚铁和氯化铜,反应的离子方程式是2Fe3+ + Cu == 2Fe2+ + Cu2+,故A正确;
B. 二氧化硅与氢氟酸反应生成四氟化硅气体和水,用HF雕刻玻璃的化学方程式是SiO2 + 4HF == SiF4↑ + 2H2O,故B正确;
C. 高炉炼铁的主要原理是高温条件下用一氧化碳还原氧化铁,反应方程式是3CO + Fe2O3 ![]() 2Fe + 3CO2,故C错误;
2Fe + 3CO2,故C错误;
D. 碳酸氢钠加热分解为碳酸钠、二氧化碳、水,小苏打做发酵粉的反应方程式是2NaHCO3 ![]() Na2CO3 + H2O + CO2↑,故D正确;
Na2CO3 + H2O + CO2↑,故D正确;
故答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
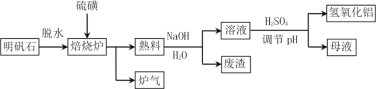
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
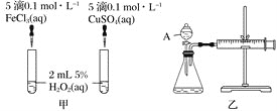
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
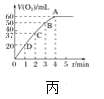
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
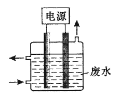
A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿茶中含有的一种物质EGCG具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的一种衍生物A的结构如图所示。有关衍生物A说法错误的是
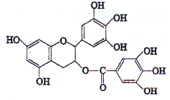
A.A能与碳酸氢钠溶液反应放出二氧化碳
B.A在空气中易氧化,遇FeCl3溶液能发生显色反应
C.1molA与足量的浓溴水反应最多可与6 mol Br2作用
D.1 molA最多可与含10mol氢氧化钠的溶液完全作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验结果的是( )
编号 | A | B | C | D |
实验方案 |
|
片刻后在 |
|
置于光亮处 |
实验结果 | 铁钉发生析氢反应 |
| 左球气体颜色加深; 右球气体颜色变浅 | 甲烷与氯气发生加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:(已知:2I-+Cl2=2Cl-+I2)
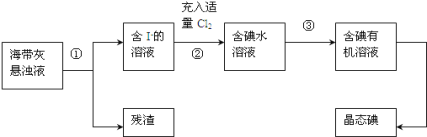
(1)指出提取碘的过程中有关的实验操作名称:①______,③ _____。
(2)过程②中充入适量Cl2的目的是(用方程式解释)_________________,把溶液中的I-转化成I2。
(3)操作③中所用的有机试剂可以是______________(只填一种)。
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
过程③正确操作步骤的顺序是:(填编号字母)_______→________→________→A→H→________→E→F。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、生产和社会可持续发展密切相关,下列有关说法或操作不正确的是( )
①为增强消毒液(有效成分NaClO)的消毒能力,可以滴加几滴浓盐酸
②新冠病毒可以采用高温或酒精来杀死,均利用的是蛋白质的变性
③常见的化学键有离子键、共价键、氢键
④石油的蒸馏、分馏、精馏是物理变化,而煤的干馏是化学变化
⑤硅酸钠俗称水玻璃
⑥苯在工业上,既可以以煤为原料制备,也可以以石油为原料制备
A.①②⑥B.①③⑤C.③⑤⑥D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是生产冠心病药物“心可安”的重要中间体。其酯类衍生物是配制香精和食品香料的重要原料。它在农用塑料和感光树脂等精细化工产品的生产中也有着广泛的应用。实验室合成肉桂酸的反应原理如下

部分物质的相关性质如下表所示:
名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 主要性质 |
苯甲醛 | 106.0 | -26 | 179 | 纯品为无色液体,微溶于水;空气中加热易被缓慢氧化 |
乙酸酐 | 102.0 | -73.1 | 138.6 | 无色透明液体;有剌激性气味;其蒸气为催泪毒气,遇水强烈水解生成乙酸,产生大量酸雾 |
肉桂酸 | 148.0 | 133 | 300 | 白色至淡黄色粉末;微有桂皮香气 |
石蜡 | / | 50-70 | 300-550 | 主要由烷烃组成,性质稳定 |
实验步骤如下:
步骤1:适量无水醋酸钾、14.5mL乙酸酐(过量)和5.0mL苯甲醛(密度为1.06g/cm3)依次加入150ml三颈烧瓶中摇匀,放入磁子,搭好回流装置,用带磁力搅拌功能的电炉(图A)加热至微沸后保持加热回流1小时;
步骤2:取下三口烧瓶,冷却至100度以下后,加入少量饱和碳酸钠溶液调节pH8-9;
步骤3:如图B连接好水蒸气蒸馏装置(加热装置略去),进行水蒸气蒸馏,直至馏出物无油滴;
步骤4:将三口烧瓶中的残余液冷却后加入活性炭,煮沸,____往滤液中边搅拌边滴加浓盐酸至pH=3,大量固体析出;
步骤5:减压过滤,洗涤,烘干,称量,测熔点。
回答下列问题:
(1)步骤1中,若用酒精灯加热,可能存在的安全隐患是__。
(2)步骤2中,加饱和碳酸钠溶液的目的是___,可观察到的明显现象是__。
(3)步骤3中,水蒸气蒸馏的目的是除去__。(填物质名称)
(4)步骤4中,缺失的操作名称是__。
(5)步骤5中,若称量得到的产品质量为4.800g,则本实验的产率为__%(保留4位有效数字)。
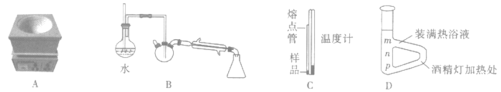
(6)有机都有固定的熔点,因此测量产品的熔点可以初步判定所得的产品是不是预期产物。测产品熔点的装置如图C所示:将产品装入一端封口的毛细玻璃管中,与温度计绑在一起,插入b形管(图D)中,用火焰持续加热b形管右侧,观察毛细管中样品的状态以及相应温度计的示数,即可测得样品的熔程(刚开始出现液滴至恰好完全熔化的温度范围)。测定过程中,温度计的水银球应位于__(填“m”、“n”或“p”),b形管中所装的热浴液可选用__(填相应字母编号)。
A.蒸馏水 B.浓硫酸 C.石蜡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com