
【题目】亚硝酸钠(NaNO2)是一种生活中常用的食品添加剂,但使用时必须严格控制其用量。某兴趣小组将下图装置连接起来制备NaNO2(装置可重复使用,A中加热装置已略去)。

兴趣小组查阅资料可知:
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+;
③在酸性条件下NaNO2能把I-氧化为I2,NO2-被还原为NO;Na2S2O3与I2的反应为2Na2S2O3+I2=Na2S4O6+2NaI
(1)连接装置的顺序为________。
(2)装置A三颈烧瓶中发生反应的化学方程式为______________;为保证制得的亚硝酸纯度,装置B中盛放的试剂可能是_________(填序号)。
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(3)C装置的目的是_____________;E装置的作用是_____________。
(4)利用NaNO2的氧化性来测定其纯度的步骤是:准确称取mgNaNO2样品放人锥形瓶中,加适量水溶解,再加过量clmol·L-lKI溶液VlmL和几滴淀粉溶液,然后滴加稀硫酸,用c2mol·L-1Na2S2O3溶液滴定消耗V2mL。
①滴定终点的判断方法是____________;②NaNO2的质量分数__________%(写出表达式即可)。
【答案】 ACBDBE C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O B、D 将NO2转化为NO 吸收多余的NO,防止污染空气 滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且三十秒内不恢复蓝色 6. 9c2V2/m
CO2↑+4NO2↑+2H2O B、D 将NO2转化为NO 吸收多余的NO,防止污染空气 滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且三十秒内不恢复蓝色 6. 9c2V2/m
【解析】(1)由已知①可得,该兴趣小组用NO和Na2O2反应制取NaNO2,所以A中生成NO2,通入C中生成NO,经B除杂和干燥后与D中Na2O2反应;由已知②可得,E为尾气吸收装置,为保证D中干燥,在D和E之间应连接干燥装置B,综上分析,连接装置的顺序为:ACBDBE。
(2)装置A三颈烧瓶中C和浓HNO3在加热时反应生成CO2、NO2和H2O,化学方程式为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;CO2和H2O都能与Na2O2反应,为保证制得NaNO2的纯度,装置B中盛放的试剂应既能吸水又能吸收CO2,P2O5和无水CaCl2只能吸水不能吸收CO2,碱石灰和生石灰既能吸水又能吸收CO2,故选BD。
CO2↑+4NO2↑+2H2O;CO2和H2O都能与Na2O2反应,为保证制得NaNO2的纯度,装置B中盛放的试剂应既能吸水又能吸收CO2,P2O5和无水CaCl2只能吸水不能吸收CO2,碱石灰和生石灰既能吸水又能吸收CO2,故选BD。
(3)由第(1)小题的分析可得C装置的目的是将NO2转化为NO;E装置的作用是吸收多余的NO,防止污染空气。
(4)①利用NaNO2的氧化性来测定其纯度,由已知:在酸性条件下NaNO2能把I-氧化为I2;Na2S2O3与I2的反应为2Na2S2O3+I2=Na2S4O6+2NaI,用Na2S2O3标准液滴定含I2的溶液,所以滴定终点的判断方法是:滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色变为无色,且三十秒内不恢复蓝色。②由2NO2-+2I-+4H+=I2+2NO+2H2O、2Na2S2O3+I2=Na2S4O6+2NaI可得关系:NO2-~Na2S2O3,所以n(NaNO2)=n(NO2-)=n(Na2S2O3)=c2V2×10-3mol,m(NaNO2)=M(NaNO2)×n(NaNO2)=69c2V2×10-3g,NaNO2的质量分数为:69c2V2×10-3g÷mg×100%=![]() %。
%。


科目:高中化学 来源: 题型:
【题目】二氧化氯是一种广谱杀菌消毒剂,有众多的用途,工业上制取二氧化氯的化学方程式如下:2NaClO3+ 2NaCl+2H2SO4![]() 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。
(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为__________L(标准状况)。
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为__________mol/L。
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2![]() 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____。
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是______________,氧化产物是___________________。
②该反应中被氧化的物质与被还原的物质物质的量之比为________________。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是__________,还原剂是___________。
②该反应中1 mol氧化剂____________(填“得到”或“失去”)____________mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是__________L。
④请把各物质填在下面空格处,需配平:
□______+□______=□______+□______+□______+□
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于胶体的下列说法中错误的是( )
A.胶体在光束透过时能产生丁达尔效应
B.不能用丁达尔效应区分溶液与胶体
C.胶体是混合物
D.胶体粒子的直径介于10-9m---10-7m之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂就能鉴别CaCl2、NH4Cl、Na2SO4、(NH4)2SO4四种溶液,此试剂是( )
A.Ba(OH)2
B.NaOH
C.HCl
D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
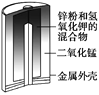
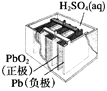
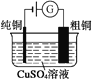
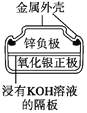
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大。A与B、C分别构成电子数相等的化合物W、K,且W是一种能产生温室效应的气体;D元素最外层电子数是次外层电子数的3倍。A、D、E构成化合物Y,A、B、C、D构成化合物X,且X、Y均为阳离子和阴离子个数比是1∶1的离子化合物。回答下列问题:
(1)推断元素D为___________。
(2)Y的电子式为_______;物质W为_______,其晶体中存在的作用力有_______。
(3)与E同主族且为第7周期的元素原子序数为________。
(4)A与C形成的K是生产某种常用肥料的重要原料,写出其被催化氧化的反应方程式______。
(5)X、Y按1∶2反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
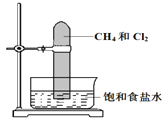
A. 试管中气体的黄绿色逐渐变浅,水面上升
B. 生成物只有三氯甲烷和氯化氢在标准状况下是气体
C. 试管内壁有油状液滴形成
D. 试管内有少量白雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年10月27日,世界工生组织国际癌症研究机构将三氯乙醛划为2A类致癌物,但它可用于生产氯霉素、合霉素等。某探究小组模拟备三氯乙醛自实验装置如图所示(夹持、加热装置均略去)。

已知:C2H5OH+4Cl2=CCl3CHO+5HCl,副反应是C2H5OH+HCl=C2H5Cl+H20。
容下列问题:
(1)写出装置A中发生反应的化学方程式:__________________。
(2)仪器b中冷凝水从________(填“p”或“q”,下同)口进,______口出。
(3)进入装置D的是纯净、干燥的Cl2,则装置B中的试剂为_____,装置C中的试剂为____。若撤去装置B,对实验的影响是____________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是__________________。
(5)已知:CCl3CHO +OH-=CHCl3+HC00-; HC00-+I2=H++2I-+CO2↑ I2+2S2O32-=2I-+S4O62-
称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L碘标准溶液,再加入适量Na2C03溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。滴定时所用指示剂是_______,达到滴定终点的现象是______,测得产品的纯度为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com