
| A. | 太阳能发电技术是将化学能转化为电能 | |
| B. | 集热技术是将太阳能转化为热能 | |
| C. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| D. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 |
分析 A.太阳能发电技术是将太阳能转化为电能;
B.集热是将太阳能转化为热能;
C.光-热转化是目前技术最成熟的利用太阳能形式;
D.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能.
解答 解:A.太阳能发电技术是将太阳能转化为电能,不是化学能,故A错误;
B.集热是将太阳能集中转化为热能,故B正确;
C.太阳能的热利用技术还处于发展阶段,目前较成熟的是太阳能热水器,太阳灶等,太阳能热发电、太阳能制冷等技术还在研究之中,故C正确;
D.远古时期生物体吸收利用太阳能,经过非常复杂的过程和漫长的时间形成,故D正确.
故选A.
点评 本题考查了能源的来源和利用,熟悉能源间的相互转化及转化的方式即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 减压蒸馏可以防止炭化结焦 | |
| B. | 石油裂化的目的是提高汽油的产量和质量 | |
| C. | 石油的常压蒸馏,减压蒸馏以及煤的干馏都是物理变化 | |
| D. | 芳香烃的主要来源是石油的催化重整和煤的干馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 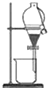 用于分离水和乙醇的混合物 | |
| B. | 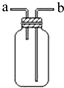 可用于H2,NH3,CO2,Cl2,HCl,NO2等气体收集 | |
| C. | 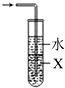 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 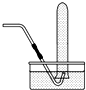 常用于实验室收集氧气、氢气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变小 | |
| B. | 常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大 | |
| C. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 | |
| D. | 已知,K=$\frac{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}{{c}^{3}({H}_{2}O)•c(C{H}_{3}C{H}_{2}OH)}$则对应的化学反应可以表示为:CH3CH2OH(g)+3H2O(g)?2CO2( g)+6H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4H中 H+的核外电子排布与He相同 | |
| B. | NH4H溶于水,所形成的溶液显碱性 | |
| C. | NH4H固体投入少量的水中,有两种气体产生 | |
| D. | NH4H与水反应时,NH4H是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
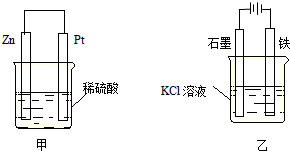
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H4;C5H8 | B. | C3H8;C5H12 | ||
| C. | CH3-CH2-CH2-CH3 ; | D. | C2H5Cl;C3H6Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
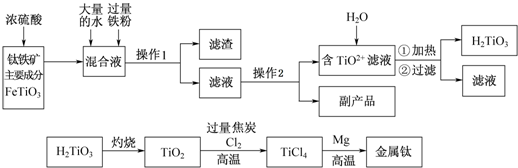
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com