
【题目】下列分散系中,具有丁达尔效应的是
A.稀硫酸B.硝酸钾溶液C.酒精溶液D.Fe(OH)3胶体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时并不能将化学能全部转化为热能
B. 原电池将化学能转化为电能
C. 二次电池放电时将电能转化为化学能
D. 镁条燃烧时将部分化学能转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
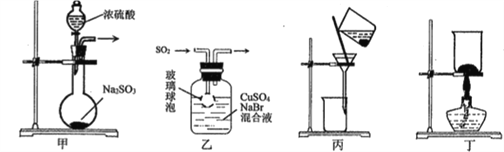
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
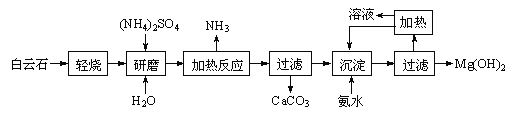
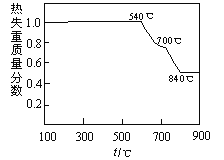
已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:
② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____(填化学式)。结合上图判断“轻烧”温度应不超过 _____。
(2)“加热反应”的化学方程式为_________________________。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______(已知)。
(4)该工艺中可以循环使用的物质是________(填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石的方法,其优点是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
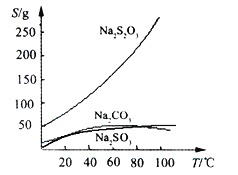
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S ![]() Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下图所示。

Ⅰ.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为_________________,装置6中可放入_____________________(填字母)。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2 ②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④Na2SO3+S![]() Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7理由是____________________________________(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并标定溶液的浓度:

(3)为减少产品的损失,操作①为__________,操作②是抽滤洗涤干燥,其中洗涤操作是用_______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高______________________________。
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-, 三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代酸钠溶液的浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和生活中有重要的应用,下列说法不正确的是
A. 小苏打在生活中可用做发酵粉 B. 过氧化钠可用于呼吸面具中氧气的来源
C. 可溶性铁盐或铝盐可用于净水 D. 碳酸钠常用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H12O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C,则有机物A的可能结构有( )
A. 1种B. 2种C. 3种D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列实验方法能够达到要求的是( )
A.用10mL量筒量取7.50mL稀盐酸
B.用湿润的pH试纸测定NaCl溶液的酸碱性
C.用广泛pH试纸测得某碱溶液pH 12.7
D.用托盘天平称量出25.20g NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种黄绿色气体.1974年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
(1)若用这两种方法制氯气,请比较,它们的发生装置使用的不同仪器是 .
(2)现将29g纯度为60%的软锰矿(主要成分MnO2)与足量的浓盐酸充分反应(杂质不参加反应),把反应后所得溶液稀释到200mL.计算:
①生成的Cl2在标准状况下的体积.
②稀释后溶液中MnCl2的物质的量浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com