
| n |
| Vaq |
| V |
| Vm |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
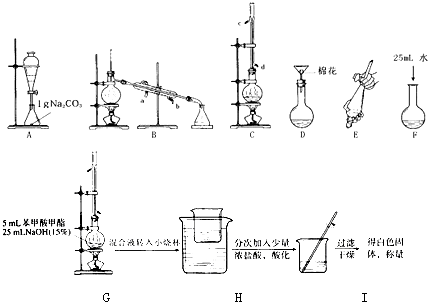
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g?cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+NH4+Cl-NO3- |
| B、Cu2+H+HCO3-Cl- |
| C、Fe3+H+Cl-SCN- |
| D、Ba2+H+NO3-Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏水 |
| B、0.5mol?L-1H2SO4溶液 |
| C、0.5 mol?L-1BaCl2溶液 |
| D、1.0mol?L-1H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、随着原子序数的递增,原子最外层电子总是从1到8重复出现 |
| B、元素的性质随着元素原子序数的递增而呈周期性变化 |
| C、随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 |
| D、元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化以及元素主要化合价的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝厂通过电解熔融氧化铝的方法冶炼铝 |
| B、制钠厂通过电解熔融氯化钠的方法生产金属钠 |
| C、用电解饱和食盐水的方法生产烧碱,同时得到氯气和氢气 |
| D、制钠厂通过电解饱和食盐水的方法生产金属钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com