
分析 (1)由题给信息可知Fe2+转化为Fe3+而中毒,服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
C.甲基橙的变色范围是3.1-4.4;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;
(3)把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,二者发生氧化还原反应,
(4)Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质;
(5)①根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从+1价降低到-1价,得到2个电子,然后根据电子的得失守恒和质量守恒定律配平方程式;
(6)依据高铁酸根具有强的氧化性,以及反应生成的三价铁离子能够水解生成氢氧化铁胶体的性质解答.
解答 解:(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中为氧化剂,所以维生素C是还原剂,
故答案为:D;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故B不选;
C.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故C选;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
故答案为:C;
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,反应的离子方程式为:NO2-+Cl2+H2O=NO3-+2H++2Cl-,
故答案为:NO2-+Cl2+H2O=NO3-+2H++2Cl-;
(4)由于Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确是双氧水,
故答案为:C;
(5)①根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从+1价降低到-1价,得到2个电子,氯元素反应化合价降低2价,最小公倍数是6,所以硝酸铁前面配2,NaClO前面配3,再根据质量守恒配平其他物质,配平后的方程式为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,故答案为:3、2、10、2、3、6、5H2O;
(6)高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,所以高铁酸钾作为水处理剂发挥的作用是净水、杀菌消毒;
故答案为:净水;杀菌消毒.
点评 本题考查综合考查铁盐和亚铁盐的相互转化,亚硝酸盐的性质,注意二价铁离子和三价铁离子的检验是高考的热点,涉及了化学方程式的配平,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为
C2H5OH+3O2===2CO2+3H2O,下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为4H++O2+4e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
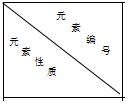 | ① | ② | ③ | ④ | ⑤[ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负化合价 | -2 | -3 | -1 | -3 |
| A. | 元素①⑧形成的化合物具有两性 | |
| B. | 元素⑦位于第二周期Ⅴ族 | |
| C. | 元素④⑤形成的化合物是离子化合物 | |
| D. | 元素⑥的最高价氧化物对应水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进行硫酸铜溶液的浓缩结晶实验需要的仪器主要有烧杯、玻璃棒、蒸发皿 | |
| B. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 | |
| C. | 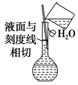 按图所示配制溶液 | |
| D. | 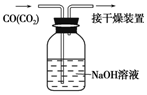 按如图可除去CO中混有的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水、牛奶、豆浆 | B. | 碘酒、泥水、血液 | ||
| C. | 白糖水、食盐水、茶叶水 | D. | Ca(OH)2悬浊液、澄清石灰水、石灰浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
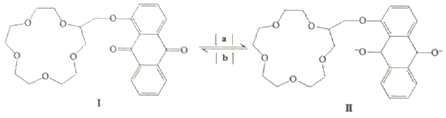
| A. | 物质Ⅰ的分子式是C25H28O8 | B. | 反应是氧化反应 | ||
| C. | 1molⅠ可与8molH2发生加成反应 | D. | 物质Ⅰ的所有原子不可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com