
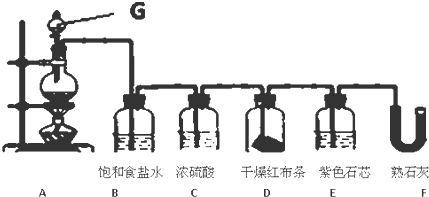
���� ��1������װ��G�Ĺ���д�������ƣ�����������ʵ�����Ʒ�д����Ӧ�Ļ�ѧ����ʽ����Ӧ�ж�������Ϊ���������Ȼ���Ϊ���������μӷ�Ӧ���Ȼ�����ֻ��һ�뱻����������ԭ����
��2�����ݸ��������������Ư���ԡ�ʪ��������ܹ����ɴ����ᣬ����Ư���Խ��н�𣻸�����ˮ�������ԡ�Ư���Է�����
��3���Ȼ�����лӷ��ԣ���ȡ�������л�����Ȼ��⣬Bװ�õ����þ��dz�ȥ�����е��Ȼ��⣻
��4������������Һ��������Ӧ�����Ȼ��ơ��������ƺ�ˮ���ݴ�д����Ӧ�����ӷ���ʽ��
��� �⣺��1��A����������װ�ã��������̺����ᷴӦ�����Ȼ��̡�������ˮ����Ӧ�����ӷ���ʽΪ��MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O����Ӧ�ж�������Ϊ���������Ȼ���Ϊ���������μӷ�Ӧ���Ȼ�����ֻ��һ�뱻����������ԭ������ԭ���������������ʵ���֮��Ϊ2��1��
�ʴ�Ϊ����Һ©���� MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O�� 2��1��
��2������������������Ư���ԣ�����Dװ���и���ĺ첼������ɫ��������ˮ��Ӧ�����Ȼ���ʹ����ᣬ��Һ��ʾ���ԣ�������ɫʯ���ȱ�ɺ�ɫ�������������Ư���ԣ����Ժܿ��ɫ����ȥ��
�ʴ�Ϊ���� �ȱ�����ɫ��
��3�������ڱ���ʳ��ˮ���ܽ�Ƚ�С����ȡ�������л�����Ȼ��⣬װ��B�б���ʳ��ˮ�������dz�ȥ�����л��е������Ȼ��⣬
�ʴ�Ϊ���������е��Ȼ��⣻
��4����������Ⱦ�����壬�����ŷŵ������У���Ҫ������������Һ���գ���Ӧ�����ӷ���ʽΪ��Cl2+2OH-�TCl-+ClO-+H2O��
�ʴ�Ϊ��Cl2+2OH-�TCl-+ClO-+H2O��
���� ���⿼����������ʵ�����Ʒ��������Ļ�ѧ���ʣ���Ŀ�Ѷ��еȣ�ע������������ʵ�����Ʒ�����ȷ�����Ļ�ѧ�����ǽ����Ĺؼ����ܹ���ȷ��д������Ӧ�����ӷ���ʽ����ѧ����ʽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �����Ȼ�̼������ȡ����ˮ��Һ�е����� | |
| B�� | ����������ͬ���칹�� | |
| C�� | ��ϩ���������������ӳɷ�Ӧ��Ҳ�ɷ��������Ӿ۷�Ӧ���ɾ���ϩ | |
| D�� | ��ά�ء����ۺ͵����ʶ��Ǹ߷��ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{2}^{3}$He����ԭ�Ӻ�����2�����Ӻ�3�����ӵĺ�ԭ�� | |
| B�� | ${\;}_{2}^{3}$He��${\;}_{2}^{4}$He�ֱ���1��2������ | |
| C�� | ${\;}_{2}^{3}$He ��${\;}_{2}^{4}$He��Ϊͬλ�� | |
| D�� | ${\;}_{2}^{3}$He������������Ϊ1������${\;}_{2}^{3}$He ���н�ǿ�Ľ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Fe | H2O��g�� | Fe3O4 | H2 | |
| ��ʼ/mol | 3.0 | 4.0 | 0 | 0 |
| ƽ��/mol | m | n | p | Q |
| Fe | H2O��g�� | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ݡ����� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CO2��3mol H2 | a��mol CO2��3a��mol H2�� b��mol CH3OH��g����b��mol H2O��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CCl4 | B�� | CH3COOH | C�� | CH3CH2OH | D�� | CaCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
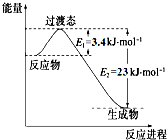 �о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
�о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����| ʵ���� | �¶� �� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com