
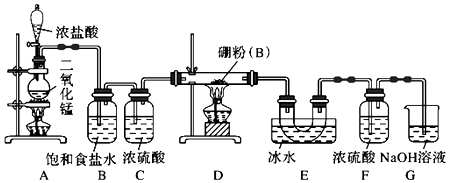
分析 BCl3遇水水解,因此由装置A生成的氯气需经装置B净化、需经装置C干燥.根据BCl3的熔点为-107.3℃,沸点为12.5℃,需用装置E将生成的BCl3蒸汽冷凝为液体.BCl3遇水水解,因此装置F的作用是防止装置G中的水蒸气进入装置E;氯气有毒,装置G的作用是吸收氯气,防止污染空气,因此为了使实验更简便,可用一个盛装碱石灰的干燥管代替装置F和G.硼能与氧气反应,为了避免氧气和硼粉反应生成B2O3,应先点燃A处酒精灯,用Cl2排尽装置中的空气,以此解答该题.
解答 解:(1)D中氯气与硼在加热条件下生成三氯化硼,反应方程式为2B+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3,故答案为:2B+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2BCl3;
(2)浓盐酸易挥发,制备的氯气中含有HCl,B中饱和食盐水除去除去Cl2中的HCl,且可以降低氯气溶解度,BCl3的沸点低,E中冰水冷却偏于收集三氯化硼,
故答案为:除去Cl2中的HCl;冷却和收集三氯化硼;
(3)由于三氯化硼遇水水解,F装置防止水蒸气加入装置E中,G为尾气处理装置,可以用一个盛装碱石灰的干燥管代替装置F和G,
故答案为:碱石灰;
(4)先用Cl2排尽装置中的空气,避免氧气和硼粉反应生成B2O3,在加热制备三氯化硼,故先点燃A处酒精灯,后点燃D处酒精灯,
故答案为:a;先用Cl2排尽装置中的空气,避免氧气和硼粉反应生成B2O3.
点评 本题考查物质制备实验,侧重于学生的分析能力和实验能力的考查,题目涉及制备气体、净化气体、干燥气体和尾气处理,明确原理是解题关键,注意题目信息的应用,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
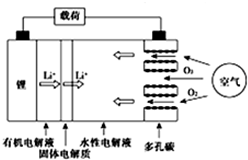 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作原理如图,下列说法正确的是( )| A. | 有机电解液可以是乙醇等无水有机物 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 电池正极反应式是O2+4e-=2O2- | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
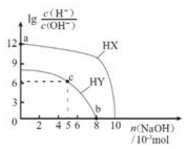 溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX、HY均为弱酸 | |
| B. | a点由水电离出的c(H+)=1.0×l0-13mol•L-l | |
| C. | c点溶液中:c(Y-)<c(Na+)<c(HY) | |
| D. | b点时,溶液的pH=7,酸碱恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com