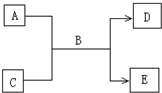
(2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则:该反应的反应方程式为
Cl2+SO2+2H2O=H2SO4+2HCl
Cl2+SO2+2H2O=H2SO4+2HCl
,检验D中阴离子的方法是
先加硝酸酸化无沉淀,再滴加AgNO3溶液有白色沉淀生成,则含Cl-
先加硝酸酸化无沉淀,再滴加AgNO3溶液有白色沉淀生成,则含Cl-
.
(2)若A为短周期的金属单质,D为气态单质,C溶液呈强酸性或强碱性时,该反应都能进行.写出反应的离子方程式
2Al+6H+=2Al3++3H2↑
2Al+6H+=2Al3++3H2↑
;
2Al+2OH-+H2O=2AlO-+H2↑
2Al+2OH-+H2O=2AlO-+H2↑
.
(3)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的化学式(写两种)
H2SiO3
H2SiO3
、
Al ( OH )3
Al ( OH )3
写出生成E的一个离子方程式
SiO32-+CO2+H2O=CO32-+H2SiO3↓或 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
SiO32-+CO2+H2O=CO32-+H2SiO3↓或 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 (2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(2009?南充模拟)A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系: