
| A. | c1=1mol•L-1 | B. | 2c1>c2 | C. | 2ω1<ω2 | D. | $\frac{{c}_{1}}{{ω}_{1}}$<$\frac{{c}_{2}}{{ω}_{2}}$ |
分析 设溶解1mol氨气的溶液密度为ρ1,溶液2mol氨气的溶液为ρ2,氨气的浓度越大,溶液密度越小,则ρ1>ρ2,
A.1mol氨气溶于1L水,溶液的体积不是1L;
B.根据c=$\frac{n}{V}$分别计算出两溶液的浓度,然后结合ρ1>ρ2讨论得出2c1、c2的关系;
C.根据溶质质量分数的表达式分别计算出两溶液的质量分数;
D.根据c=$\frac{1000ρω}{M}$可知$\frac{c}{ω}$=$\frac{1000ρ}{M}$,结合ρ1>ρ2进行判断.
解答 解:标准状况下22.4L、44.8L氨气的物质的量分别为1mol、2mol,质量分别为:17g/mol×1mol=17g、17g/mol×2=34g,
设溶解1mol氨气的溶液密度为ρ1,溶液2mol氨气的溶液为ρ2,氨气的浓度越大,溶液密度越小,则ρ1>ρ2,
A.溶液体积不是1L,则溶液的浓度不是1mol/L,故A错误;
B.1L水的质量为1000g,则溶解1mol氨气的溶液浓度为:c1=$\frac{1mol}{\frac{1000g+17g/mol×1mol}{{ρ}_{1}}}$=$\frac{{ρ}_{1}}{1017}$mol/L,溶质质量分数为:ω1=$\frac{17g}{1000g+17g}$=$\frac{17}{1017}$;
溶解2mol氨气的溶液浓度为:c1=$\frac{2mol}{\frac{1000g+17g/mol×2mol}{{ρ}_{2}}}$=$\frac{2{ρ}_{2}}{1034}$mol/L,溶质质量分数为:ω2=$\frac{34g}{1000g+34g}$=$\frac{34}{1034}$,则:$\frac{{c}_{1}}{{c}_{2}}$=$\frac{1034{ρ}_{1}}{1017×2{ρ}_{2}}$,由于ρ1<ρ2,则$\frac{{c}_{1}}{{c}_{2}}$>$\frac{1}{2}$,即2c1>c2,故B正确;
C.溶质质量分数2ω1=$\frac{17}{1017}$×2=$\frac{34}{1017}$>ω2=$\frac{34}{1034}$,故C错误;
D.根据c=$\frac{1000ρω}{M}$可知,$\frac{c}{ω}$=$\frac{1000ρ}{M}$,M相同,则该比值与密度成正比,由于ρ1>ρ2,则$\frac{{c}_{1}}{{ω}_{1}}$>$\frac{{c}_{2}}{{ω}_{2}}$,故D错误;
故选B.
点评 本题考查了物质的量浓度与溶质质量分数的计算与判断,题目难度中等,明确物质的量浓度、溶质质量分数的表达式为解答关键,注意氨水浓度越大,其密度越小,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、O-H键为463,则断裂1mol N-H键所需的能量是( )
有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、O-H键为463,则断裂1mol N-H键所需的能量是( )| A. | 658 | B. | 516 | C. | 391 | D. | 194 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
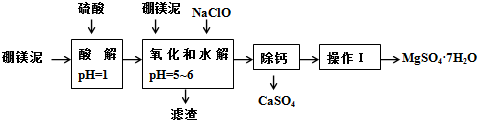
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com