
在指定的条件下,下列各组离子能大量共存的是( )
A.使甲基橙变红的溶液中:Fe2+、Na+、I-、NH4+
B.强碱性溶液中:K+、Na+、ClO-、S2-
C.0.1 mol·L-1 NaAlO2溶液中:H+、Na+、Cl-、SO42-
D.由H2O电离出的c(H+)=10-11mol/L溶液中:Na+、HCO3-、AlO2-、SO42-
A
【解析】
试题分析:A、给定条件下,组内离子间不反应,能大量共存,正确;B、强碱性溶液中,ClO-和S2-间发生氧化还原反应,不能大量共存,错误;C、0.1 mol·L-1 NaAlO2溶液中,H+和AlO2-之间发生反应:AlO2- + H+ + H2O ====Al(OH)3↓ 或AlO2- + 4H+ ====Al3+ + 2H2O,不能大量共存,错误;D、由H2O电离出的c(H+)=10-11mol/L溶液既可能为强酸溶液,又可能为强碱溶液,强酸性条件下,发生反应: HCO3- + H+ ==== CO2↑ + H2O,强碱性条件下发生反应:HCO3- + OH- ==== CO32- + H2O,不能大量共存,错误。
考点:考查离子反应、离子大量共存问题。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高二化学试卷(解析版) 题型:选择题
下列各类有机物:①饱和一元醇 ②饱和一元醛 ③饱和一元羧酸 ④饱和一元醇与饱和一元酸生成的酯 ⑤乙炔的同系物 ⑥苯的同系物 ⑦烯烃的同系物,完全燃烧时产生的水和二氧化碳的物质的量之比恒定的是:( )
A.①③⑤⑦ B.①④⑥ C.②③④⑦ D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列各组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是( )
A. Na2O 和 SiO2 B.冰和金刚石熔化
C.氯化 钠和蔗糖熔化 D.碘和干冰升华
钠和蔗糖熔化 D.碘和干冰升华
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:填空题
(8分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正) = v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是 ( )( )。
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列叙述中不正确的是( )
A.目前,我国城市环境污染中的大气污染物主要是SO2、NO2、CO、烟尘
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
两种大气污染物NO2和SO2在一定条件下可发生如下反应:NO2 + SO2 NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
A. B.
B.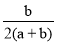 C.
C.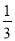 D.
D.
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:实验题
过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。
已知:2Na2CO3+3H2O2=2Na2CO3·3H2O △H<0;回答下列问题:
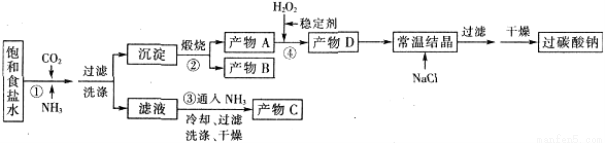
(1)下列物质可使过碳酸钠较快失效的是(填序号)_________。
A. FeCl3溶液 B. H2S C. 稀硫酸 D. NaHCO3溶液
(2)反应①应先通入的气体是__________。
(3)在上述流程中,向反应前的H2O2中加入稳定剂的作用是____________________。
(4)该生产流程中可循环使用的物质是______________________________(填化学式)。
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,请简述该步操作过程___________。
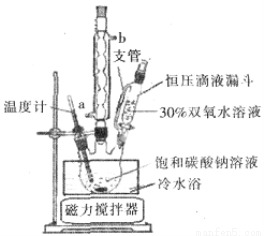
(6)实验室利用下图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是_______,冷凝管应从__________处进水。
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是_______________。
T/℃ | 活性氧百分含量 | 产率 |
5~10 | 13.94 | 85.49 |
10~15 | 14.02 | 85.78 |
15~20 | 15.05 | 88.38 |
20~25 | 14.46 | 83.01 |
 、
、
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:填空题
(14分)2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
⑴火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H=- 534 kJ·mol-1 ①
H2O2(1)=H2O(1)+1/2O2(g) △H=- 98.64 kJ·mol-1 ②
H2O(1)=H2O(g) △H=+44kJ·mol-l ③
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H= ,
⑵据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作 原料的燃 料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电,其工作原理如图所示。
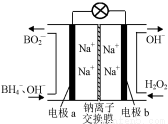
则该电池的正极反应____ ___
⑶H2O2是一种不稳定易分解的物质。右图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图 。

⑷某化学兴趣小组欲测定H2O2的分解速率,取溶液0.5L进行分析,数据如表格所示:
t(S) | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2O2) (moL) | 0.8 | 0.7 | 0.62 | 0.55 | 0.27 | 0.03 |
在上述表格中已知某一时刻向H2O2溶液中加入催化剂,则加入催化剂后整段时间内H2O2的平均分解速率___________。
⑸H2O2还是一种药物化学分析的氧化剂,能用于药物的分析。

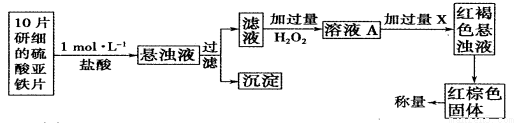
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为
_________(小数点后面保留一位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com