
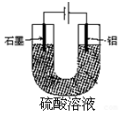
 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )| A. | 阳极电极方程式为Al-3e+6OH-=Al2O3+3H2O | |
| B. | 随着电解的进行,溶液的pH逐渐增大 | |
| C. | 当阴极生成气体3.36L(标况)时,阳极增重2.4g | |
| D. | 电解过程中H+移向Al电极 |
分析 A、根据电解质为硫酸溶液可知:在阳极金属铝失去电子生成氧化铝和氢离子,不会有氢氧根离子参与反应;
B、根据电解池工作原理写出总反应,然后判断溶液的pH变化;
C、阴极生成为氢气,计算出氢气的物质的量,然后利用差量法计算出阳极增重的质量;
D、先判断电流方向,然后判断氢离子所带电荷判断氢离子的移动方向.
解答 解:A、电解质为硫酸溶液,氢氧根离子不可能参加反应,阳极反应为:Al-3e-=3Al3+,故A错误;
B、根据原电池装置和题目信息可知电解总反应为:2Al+3H2O$\frac{\underline{\;通电\;}}{\;}$Al2O3+3H2↑,水减少,溶液的pH逐渐减小,故B错误;
C、阴极反应为:2H+-2e-=H2↑,氢气的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,则转移的电子的物质的量为:2×0.15mol=0.3mol,阳极反应为:2Al+3H2O-6e-=Al2O3+6H+;根据质量差法进行计算:设阳极增重的质量为x,
2Al+3H2O-6e-=Al2O3 +6H+△m
6mol 48g
0.3mol x
6mol:0.3mol=48g:x,
解得x=2.4g,即阳极增重2.4g,故C正确;
D、根据电流方向可知,阳离子向着阴极移动,铝为阳极,石墨为阴极,所以氢离子向着石墨移动,故D错误;
故选C.
点评 本题考查电解原理、电解方程式的书写及计算,题目难度中等,注意掌握原电池、电解池工作原理,选项C为难点和易错点,注意利用差量法进行计算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用新能源,减少化石燃料的燃烧,可防止酸雨的产生 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 建设三峡大坝使用了大量水泥,水泥是使用量最大的无机非金属材料之一 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量AlCl3溶液滴入过量的NaOH溶液中:Al3++4OH-=AlO2-+2H2O | |
| B. | 将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+=Cu+2Na+ | |
| C. | FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ | |
| D. | 氯气溶解于水:Cl2+H2O?2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mol浓盐酸与足量的二氧化锰反应生成1mol氯气 | |
| B. | 青铜是我国使用最早的合金,它的硬度和熔点都比铜的大 | |
| C. | 二氧化硅导电性能好,可用作光导纤维 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是白色固体 | B. | 都是强氧化剂 | ||
| C. | 与酸反应的生成物都是盐和水 | D. | 都能与水反应形成强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64 g | |
| B. | 标准状况下18 g水的体积是22.4 L | |
| C. | 14g N2含有的分子数为0.5NA | |
| D. | 1mol/LMgCl2溶液中含有Cl-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含D的盐溶液一定显酸性 | |
| B. | 可电解熔融DE3冶炼D单质 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 1 mol 由元素A、B组成的化合物可能含有18 mol e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com