
分析 13.6g CaO和NaOH的混合物溶于水后消耗HNO3为0.08mol×$\frac{1000mL}{200mL}$=0.4mol,反应生成NaNO3、Ca(NO3 )2,结合CaO、NaOH总质量及电荷守恒列方程计算CaO、NaOH各自物质的量,进而计算原混合物中CaO的质量百分含量.
解答 解:13.6g CaO和NaOH的混合物溶于水后消耗HNO3为0.08mol×$\frac{1000mL}{200mL}$=0.4mol,反应生成NaNO3、Ca(NO3 )2,
设原混合物中CaO、NaOH的物质的量分别为xmol、ymol,
根据混合物总质量,可得:56x+40y=13.6
根据电荷守恒,可得:2x+y=0.4
联立方程,解得x=0.1,y=0.2
故CaO的质量为0.1mol×56g/mol=5.6g,
则原混合物中CaO的质量百分含量为$\frac{5.6g}{13.6g}$×100%=41.2%,
答:原混合物中CaO的质量百分含量为41.2%.
点评 本题考查混合物有关计算,关键是明确发生的反应,注意守恒法的运用,有利于培养学生分析计算能力、知识迁移运用能力.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题
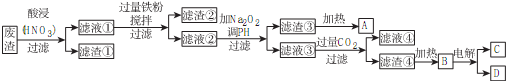
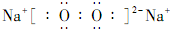 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
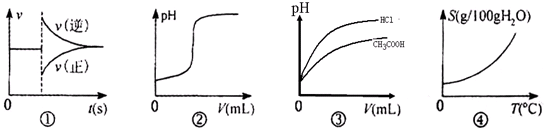
| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH的变化 | |
| C. | 图③可以表示相同pH的醋酸和盐酸溶液分别加水稀释时溶液的pH随体积的变化 | |
| D. | 图④可以表示所有的固体物质溶解度随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
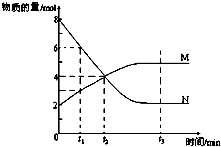 一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3→Na++CO32- | B. | H2S→2H++S2- | ||
| C. | H2CO3→H++HCO3- | D. | NaHSO4→Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A与B的相对分子质量之比为m:n | |
| B. | 同温同压下,两气体A与B的密度之比为n:m | |
| C. | 同质量的A与B分子个数之比为m:n | |
| D. | 相同状况下,同体积的气体A与B 质量比为m:n |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
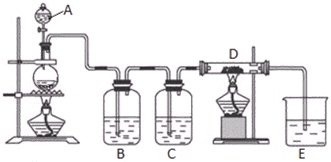
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 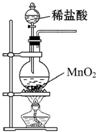 制取少量Cl2 | |
| B. | 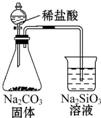 证明非金属性Cl>C>Si | |
| C. | 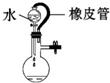 水不能持续流下,说明装置气密性良好 | |
| D. | 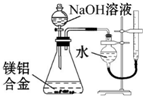 测定镁铝合金中铝的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
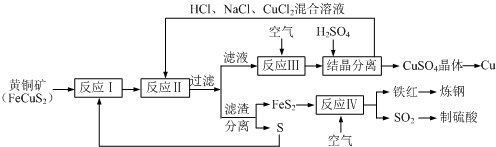
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com