
| A. | 8种 | B. | 10种 | C. | 16种 | D. | 20种 |
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/LNa2CO3溶液:c(Na+)=2c(H2CO3)+2 c(HCO3-)+c(CO32?) | |
| B. | 能使酚酞溶液呈红色的溶液:Na+、Ba2+、I-、NO3-可以大量共存 | |
| C. | 任何条件下,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 将0.2 mol•L-1的HCN溶液和0.1 mol•L-1的NaOH溶液等体积混合,溶液显碱性,则c(HCN)=c(CN-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
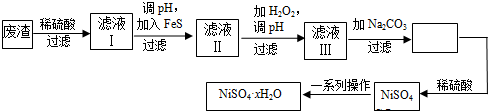
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.
某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
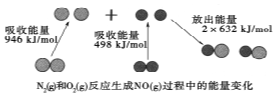 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | 在1L的容器中发生反应,10min内 N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L•min) | |
| D. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com