
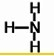
 ,
, ;
;

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、32gO3所含有的原子数目与1molO2所含原子物质的量相等 |
| B、4g金属钙变成钙离子时失去的电子数目为0.1NA |
| C、1molCH3+所含的电子数为10NA |
| D、标准状况下,22.4L H2O所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
3- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
B、 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
C、 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
D、 向NaAlO2溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C | - 3 |
| C | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com