
| A. | 互称为同分异构体的物质不可能具有相同的通式 | |
| B. | 具有相同官能团的有机物不一定是同系物 | |
| C. | 糖类、油脂、蛋白质都是仅含C、H、O元素的有机物 | |
| D. | 燃烧产物是CO2、H2O的有机物一定烃类 |
分析 A.有机物中存在碳链异构的通式相同;
B.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
C.蛋白质中含氮元素;
D.烃的含氧衍生物燃烧也生成二氧化碳和水.
解答 解:A、有机物中存在碳链异构的通式相同,如正丁烷与异丁烷互为同分异构体,二者具有相同的通式,故A错误;
B.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,具有相同官能团的有机物不一定是同系物,如环己醇与乙醇,二者结构不同,不是同系物,故B正确;
C.糖类、油脂都是仅含C、H、O元素的有机物,蛋白质含C、H、O、N四种元素,故C错误;
D.燃烧产物是CO2、H2O的有机物不一定是烃类,可以是烃的衍生物,如醇、醛、羧酸等,故D错误;
故选B.
点评 本题考查了有机物同分异构体现象、烃的衍生物的组成元素、同系物概念实质理解应用,掌握基础是解题关键,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.2mol•L-1•min-1 | B. | v(NO2)=0.2mol•L-1•min-1 | ||
| C. | v(H2O)=0.005mol•L-1•s-1 | D. | v(N2)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题



 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用惰性电极电解氯化钠溶液:4Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cl2↑+2H2↑+O2↑ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NaHCO3溶液中与滴加少量Ca(OH)2溶液:CO32-+Ca2+═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大空气进入量或减小石油气进入量 | |
| B. | 增大空气进入量,增大石油气进入量 | |
| C. | 减小空气进入量,减小石油气进入量 | |
| D. | 减小空气进入量或增大石油气进入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
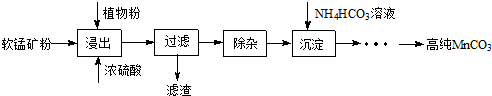
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com