
【题目】A.B.C.D.E.F六种短周期元素的原子序数依次增大。已知A.C.F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A___________,D___________,E___________;
(2)用电子式表示B、F形成的化合物___________;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式_____________;
(4)D的固态氧化物是________晶体。含n mol D的氧化物的晶体中含D-O共价键为_______mol
【答案】(1)Na;Si;P
(2)![]()
(3)Al(OH)3+OH-=AlO2-+2H2O
(4)原子;4n
【解析】试题分析:A、B、C、D、E、F六种短周期元素的原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E原子有3个电子层,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg。
(1)由上述分析可知,A为Na,D为Si,E为为P。
故答案为:Na;Si;P;
(2)B、F形成的化合物为氯化镁,用电子式表示其形成过程为![]() 。
。
故答案为:![]() ;
;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式为:Al(OH)3+OH-═AlO2- +2H2O。
故答案为:Al(OH)3+OH-═AlO2- +2H2O;
(4)D为Si元素,其氧化物为二氧化硅,二氧化硅属于原子晶体;Si能形成4个共价键,nmol二氧
化硅中含有nmolSi原子,所以nmol二氧化硅含4nmolSi-O键。
故答案为:原子;4n。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①③⑤ B.②③⑤
C.②⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下:
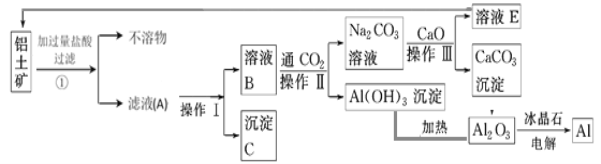
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有______________________ 。
(2)写出滤液A中一种溶质与过量NaOH溶液反应进入滤液B中的离子方程式_______________________________。
(3)若步骤①中没有过滤操作而直接进入步骤②,对后面操作将产生的影响是_______________________________。
(4)写出由溶液B生成Al(OH)3的离子方程式:_______________________________。
(5)工艺流程中涉及氧化还原反应的化学方程式为_______________________________。
(6)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有 (填化学式)。用此法制取铝的副产品是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届邯郸一模】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究。
【定性实验】检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是_______和_______;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是__________________;
【定量试验】测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图所示.
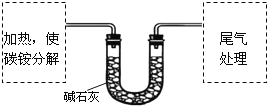
(3)碳铵固体应放在________中进行加热.
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
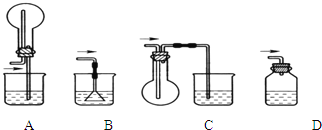
(4)从安全的角度考虑,尾气处理的装置可以选用________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_____g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量.请你评价该方案是否合理;_______(填“合理”“不合理”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5·H2O和Fe3O4。
(1)铁元素位于元素周期表中的第 族,在水溶液中常以Fe2+、Fe3+的形式存在,其中 更稳定。
(2)以硼酸为原料可制得NaBH4 ,B原子的杂化方式为 。
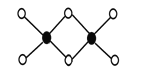
(3)工业上冶炼铝不用氯化铝,因为氯化铝易升华,其双聚物Al2Cl6结构如图所示。1mol该分子中含 个配位键,该分子 (填“是”或“否”)平面型分子。
(4)Al单质为面心立方晶体,其晶胞的边长a=0.405nm,列式表示Al单质的密度:_________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)与![]() 等电子体的分子 ,根据等电子体原理在
等电子体的分子 ,根据等电子体原理在![]() 中氮原子轨道杂化类型是__________;
中氮原子轨道杂化类型是__________;![]() 与N2是等电子体,1 mol
与N2是等电子体,1 mol![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)O3分子是否为极性分子?__________。(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇可以有效利用资源,同时又可控制温室气体.原理为:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
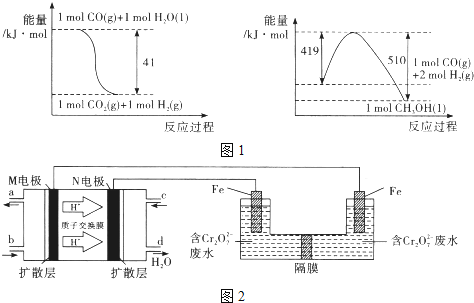
(1)由图1所示的能量变化,写出将CO2转化为甲醇的热化学方程式_____________。
(2)一定温度下,若上述制备甲醇的反应在体积为2L的密闭容器中进行并保持温度不变,起始时投入1moICO2、4molH2,达到平衡时H2与CO2的物质的量之比为8 :1 , CO2的转化率是_____________.
(3)以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含Cr2O72-)时,实验室利用图2装置模拟该法:
①M区发生反应的电极反应式为___________。
②己知电解池溶液里以Cr2O72-转化为Cr3+,该反应的离子方程式________________。
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当Cr3+沉淀完全,溶液的pH_______________。(己知Ksp[Cr(OH)3]=6.4×10-31,lg2=0.3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
① Na2O2和H2O ② Al和NaOH溶液 ③ MnO2和浓盐酸共热 ④ 铜片和浓硫酸共热
A. 只有①② B. 只有①③ C. 只有②③ D. 只有③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com