
| A. | ①②⑥ | B. | ②④⑤ | C. | ②④ | D. | ⑤⑥ |
分析 ①17g甲基(-14CH3)的物质的量为1mol,该甲基中含有8个中子;
②常温常压下,气体摩尔体积大于22.4L/mol,根据n=$\frac{V}{{V}_{m}}$分析;
③室温下,28.0g乙烯和丙烯的最简式为CH2,根据最简式计算出含有C、H原子的物质的量,乙烯和丙烯分子中,每个C、H原子平均形成1个共价键,据此进行计算;
④CaO2中阴离子为过氧根离子,化学式CaO2中含有2个离子;
⑤标准状况时,氟化氢的状态不是气态;
⑥苯分子中的碳碳键是介于单键和双键之间的独特键,不存在碳双键.
解答 解:①常温常压下,17g甲基(-14CH3)的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol-14CH3中含有8mol中子,含有中子数为8A,故①错误;
②常温常压下,气体摩尔体积大于22.4L/mol,则22.4LNO的物质的量小于$\frac{22.4L}{22.4L/mol}$=1mol,含有的分子数小于NA,故②正确;
③室温下,28.0g乙烯和丙烯的混合气体中含有28.0g最简式CH2,含有最简式的物质的量为:$\frac{28g}{14g/mol}$=2mol,则混合物中含有2molC、4molH原子,由于乙烯和丙烯分子中,每个C、H原子平均形成1个共价键,则混合物中含有共价键数目约为4×6.02×1023个,故③错误;
④7.2g CaO2的物质的量为:$\frac{7.2g}{72g/mol}$=0.1mol,0.1mol CaO2中含有0.1mol钙离子和0.1mol过氧根离子,总共含有0.3mol离子,含有离子的数目为6.02×1022,故④正确;
⑤标准状况时,22.4L氟化氢的状态不是气态,不能使用标况下的气体摩尔体积计算,故⑤错误;
⑥苯分子中的碳碳键为一种独特键,其分子中不存在碳碳双键,故⑥错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的 | |
| B. | 某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强 | |
| C. | H2CO3的电离常数表达式:K=$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$ | |
| D. | 电离平衡常数可以表示弱电解质的相对强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
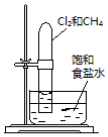 置于光亮处 置于光亮处 | 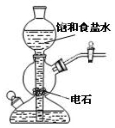 |
| A.验证甲烷与氯气发生化学反应 | B.实验室制乙炔 |
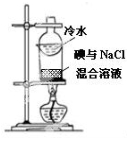 | 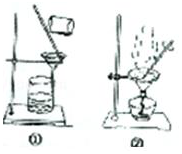 |
| C.从碘与氯化钠的混合溶液中分离碘 | D.粗苯甲酸的提纯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
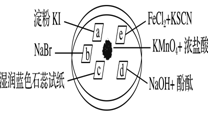 如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | e处变红色 | 还原性:Fe2+>Cl- |
| D | d处立即褪色 | 氯气与水生成了漂白性物质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NH4C1溶液溶解Mg(OH)2:Mg(OH)2+2NH4 +═Mg2十+2NH3•H2O | |
| B. | 用氨水除去NH4 C1溶液中的FeC13:Fe3++3OH-═Fe(OH)3 | |
| C. | Na2S水解:S2-+2H2O?H2S+2OH- | |
| D. | 用H2S气体作为沉淀剂除去溶液中的Cu2+:Cu2++S2-═CuS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质(括号内为杂质) | 试剂 | |
| A | CO2(SO2) | Na2CO3溶液 |
| B | FeCl3溶液(CuCl2) | Fe |
| C | Fe2O3(Al2O3) | NaOH溶液 |
| D | Na2SO4溶液(Na2CO3) | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | C4H9Cl有3种同分异构体 | |
| D. | 光照条件下,甲烷通入氯水中,氯水黄绿色褪去,说明甲烷与氯水发生了取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com