
| A. | 3:7 | B. | 3:4 | C. | 4:7 | D. | 1:3 |
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,结合分子式可知n(C)=n(CO)+n(CO2),根据总质量计算O元素质量,再根据n=$\frac{m}{M}$计算O原子物质的量.
解答 解:标况下CO和CO2组成的混合气体13.44L,它们总物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,
则混合物中n(C)=n(CO)+n(CO2)=0.6mol,
则混合物中氧元素质量为24g-0.6mol×12g/mol=16.8,则n(O)=$\frac{16.8g}{16g/mol}$=1.05mol,
故混合物中C和O两种原子的物质的量之比为0.6mol:1.05mol=4:7,
故选:C.
点评 本题考查物质的量有关计算,关键是根据分子式确定碳原子物质的量与混合气体物质的量关系,也可以列方程计算CO与二氧化碳各自物质的量.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应产生大题氢气的溶液:NH4+、Na+、CO32-、NO3- | |
| B. | 能使硫氰化钾溶液显红色的溶液:K+、SO42-、S2-、SO32- | |
| C. | 常温下pH值为13的溶液中:K+、HCO3-、Na+、Cl- | |
| D. | 在使石蕊试液变红的溶液中:Na+、Cu2+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaOH | ||
| C. | CH3COONa NaOH | D. | Na2CO3 CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
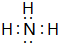 .
.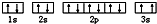 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
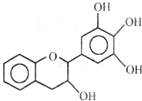 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素( EGC )的结构如图所示.关于 EGC 的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素( EGC )的结构如图所示.关于 EGC 的下列叙述中不正确的是( )| A. | 能发生加成反应、氧化反应和取代反应 | |
| B. | 遇 FeC13溶液能发生显色反应 | |
| C. | 分子中所有的原子可能共平面 | |
| D. | lmolEGC与4mo1NaOH恰好完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com