

| A. | 引发该反应一定需要加热或点燃等条件 | |
| B. | E1逆反应的活化能,E2是正反应的活化能 | |
| C. | 催化剂能减小E1和E2,但不改变反应的焓变 | |
| D. | X、Y、Z表示的反应速率之比为2:1:1 |
科目:高中化学 来源: 题型:解答题
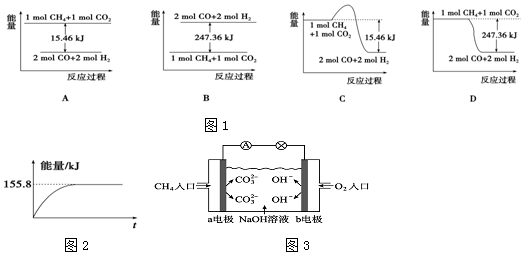
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
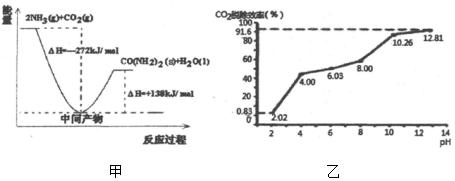
| 容器 | 甲 | 乙 | 丙 |
| 起始反应物投入量 | 2molH2、1molCO | 1molCH3OH | 2mol CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性Na>Mg>Al | B. | 原子半径大小:S>Cl>F | ||
| C. | 稳定性 PH3>H2S>HF | D. | 碱性强弱:KOH>NaOH>LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
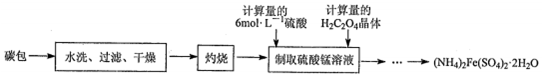
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl | B. | CHCl3 | C. | CCl4 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸与足量金属Na反应生成生成lmolH2 | |
| B. | 1mol苹果酸可与3molNaOH发生中和反应 | |
| C. | 苹果酸中能发生酯化反应的官能团有2种 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com