
| A. | 1,3-丁二烯的分子式:C4H6 | B. | 溴乙烷的电子式: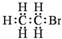 | ||
| C. | 甲醛的结构式: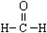 | D. | 葡萄糖的结构简式:CH2OH(CHOH)4CHO |
分析 A.1,3-丁二烯分子中含有2个碳碳双键,其分子中含有4个C、6个H;
B.溴乙烷为共价化合物,溴原子最外层达到8电子稳定结构;
C.甲醛分子中含有1个碳氧双键和1个碳氢键;
D.葡萄糖分子中含有5个羟基和1个醛基.
解答 解:A.1,3-丁二烯分子中含有2个碳碳双键,其分子式为:C4H6,故A正确;
B.溴乙烷为共价化合物,溴乙烷分子中存在5个碳氢共用电子对、一个碳溴共用电子对,溴乙烷的电子式为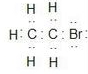 ,故B错误;
,故B错误;
C.甲醛为含有1个C的醛,其结构式为: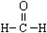 ,故C正确;
,故C正确;
D.葡萄糖分子中含有6个C原子,为多羟基醛,其结构简式为:CH2OH(CHOH)4CHO,故D正确;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、分子式、结构式、结构简式等知识,明确常见化学用语的表示方法为解答关键,试题侧重考查学生的规范答题能力.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ③④⑤ | C. | ④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 元素原子得电子能力逐渐增强 | ||
| C. | 气态氢化物稳定性逐渐增强 | D. | 最高化合价逐渐增高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
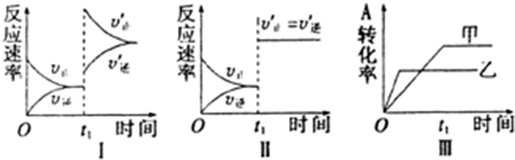
| A. | ①② | B. | ②③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
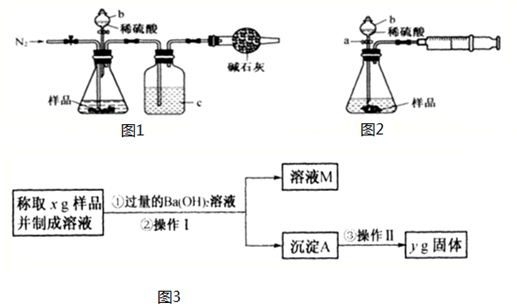
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
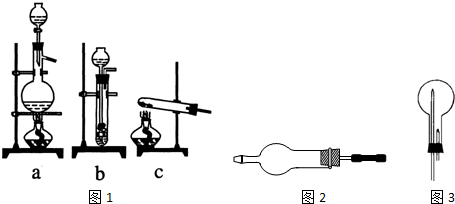
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com