
【题目】硫代硫酸钠晶体(Na2S2O35H2O)易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业上制取硫代硫酸钠晶体,反应装置和试剂如下图:
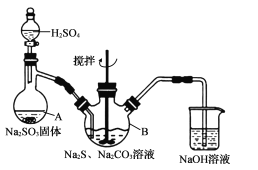
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通人Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
回答下列问题:
(l)仪器A的名称是____,Na2S的电子式为____。
(2)三颈烧瓶B中制取Na2S203反应的总化学方程式为_______________
(3)从上述生成物混合液中获得较高产率Na2S2O3.5H2O的步骤为
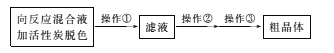
为减少产品的损失,操作①为趁热过滤,“趁热”的目的是____;操作②是____;操作③是抽滤、洗涤、干燥。
(4)测定Na2S203.5H2O纯度取6.00 g产品,配制成100 mL溶液。取10. 00 mL溶液,以淀粉溶液为指示剂,用浓度0. 0500 mol/L的标准溶液进行滴定,反应原理为2S2O32-+I2![]() S4O62-+2I-,相关数据记录如下表所示。
S4O62-+2I-,相关数据记录如下表所示。
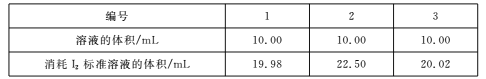
Na2S2035H20的纯度为____%(保留1位小数)。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为________________________________________
【答案】蒸馏烧瓶 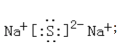 4SO2+2Na2S+Na2CO3=3Na2S203+CO2 为了防止晶体在漏斗中大量析出导致产率降低 蒸发浓缩,冷却结晶 82.7% S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+
4SO2+2Na2S+Na2CO3=3Na2S203+CO2 为了防止晶体在漏斗中大量析出导致产率降低 蒸发浓缩,冷却结晶 82.7% S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+
【解析】
(l)仪器A是蒸馏烧瓶;Na2S为离子化合物,根据组成写出Na2S的电子式;
(2)二氧化硫、硫化钠、碳酸钠混合反应生成Na2S203和CO2,据此写出反应方程式;
(3) 趁热过滤,防止溶液中Na2S2O35H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,据此进行分析;
(4) 根据实验数据计算出消耗标准液的体积,注意数据的选用;根据2S2O32--- I2关系可知n(Na2S2O35H2O)=2n(I2),然后根据题给数据计算出产品纯度。
(l)仪器A的名称是蒸馏烧瓶;Na2S为离子化合物,Na2S的电子式为:
综上所述,本题答案是:蒸馏烧瓶;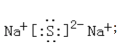
(2)二氧化硫、硫化钠、碳酸钠混合反应生成Na2S203和CO2,反应的总化学方程式为:
4SO2+2Na2S+Na2CO3=3Na2S203+CO2;综上所述,本题答案是:4SO2+2Na2S+Na2CO3=3Na2S203+CO2。
(3) 从上述生成物混合液中获得较高产率Na2S2O35H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O35H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,所以操作①趁热过滤,其目的是:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质,操作②是蒸发浓缩,冷却结晶;
因此,本题正确答案是:为了防止晶体在漏斗中大量析出导致产率降低;蒸发浓缩,冷却结晶。
(4) 第二组实验数据相差较大,舍去,故消耗标准液的体积为(19.98+20.02)/2=20.00mL,根据2S2O32--- I2关系可知n(Na2S2O35H2O)=2n(I2),故产品纯度为: [20×10-3×0.05×2×(100/10)×248]/6×100%=82.7%;综上所述,本题答案是:82.7%。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+;综上所述,本题答案是:S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+。


科目:高中化学 来源: 题型:
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
![]() 实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
![]() 应选择____mL的容量瓶,用天平称取____g NaOH。
应选择____mL的容量瓶,用天平称取____g NaOH。
![]() 溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
![]() 有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
![]() 选择下列实验方法分离物质,将分离方法的序号填在横线上。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
![]() 萃取分液
萃取分液 ![]() 升华
升华 ![]() 结晶
结晶 ![]() 过滤
过滤 ![]() 蒸馏
蒸馏 ![]() 分液
分液
![]() 分离饱和食盐水与沙子的混合物______;
分离饱和食盐水与沙子的混合物______;
![]() 从硝酸钾和氯化钠的混合液中获得硝酸钾______;
从硝酸钾和氯化钠的混合液中获得硝酸钾______;
![]() 从碘水中提取碘单质______;
从碘水中提取碘单质______;
![]() 分离水和汽油的混合物______;
分离水和汽油的混合物______;
![]() 分离
分离![]() 沸点为
沸点为![]() 和甲苯
和甲苯![]() 沸点为
沸点为![]() 的混合物______。
的混合物______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种饱和一元醇A3.7g,在足量的氧气中完全燃烧后,将所得产物通过足量澄清石灰水时,增重13.3g,若将其先通过浓硫酸,则增重4.5g。若让该物质与足量的钠反应,则可生成标准状况下的氢气0.56L。试求:
(1)A的分子式_____________。
(2)又知该醇在一定条件下发生消去反应时,可生成互为同分异构体的两种烯烃。试写出A的结构简式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2SO4 和Ca(OH)2含有化学键类型相同
B. 水分子很稳定,是因为水分子的分子间作用力强
C. 二氧化碳和乙烯的碳原子的最外电子层都具有8电子稳定结构
D. 冰和水晶都是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体免疫球蛋白中, IgG 由 4 条肽链构成,共有 764 个氨基酸,则该蛋白分子中至少含有游离的氨基和羧基数分别是( )
A. 746 和 764 B. 760 和 760 C. 762 和 762 D. 4 和 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.难溶于水的化合物是非电解质
B.某化合物的水溶液可以导电,所以该化合物是电解质
C.硫酸是电解质,所以硫酸在熔化时或溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置或操作进行的相应实验,能达到实验目的的是

A. 用图甲所示装置分离乙醇和碘的混合液
B. 用图乙所示操作配制100mL 0.1mol·L-1硫酸溶液
C. 用图丙所示装置制备、收集纯净的一氧化氮
D. 用图丁所示装置检验浓硫酸与蔗糖反应产生的二氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com