
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
分析 (1)①2NO2(g )═N2O4(g)△H=-56.9kJ•mol -1
②H2O(g)=H2O(l)△H=-44.0kJ•mol -1
③CH4(g)+N2O4 (g)=N2(g)+2H2O(l)+CO2 (g)△H=-898.1kJ•mol -1
盖斯定律计算①+③-2×②得到 CH4(g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式;
(2)①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②计算NO反应速率v=$\frac{△c}{△t}$,反应速率之比等于化学方程式计量数之比计算得到氮气的反应速率;
③根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
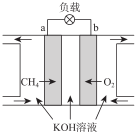
(4)①CH4燃料电池中甲烷在负极失电子发生氧化反应,在碱性环境中生成碳酸盐,结合电话守恒和原子守恒书写电极反应;
②放电一段时间后,依据化学方程式分析,消耗溶液中氢氧根离子生成水,电解质溶液的pH减小.
解答 (1)(1)①2NO2(g )═N2O4(g)△H=-56.9kJ•mol -1
②H2O(g)=H2O(l)△H=-44.0kJ•mol -1
③CH4(g)+N2O4 (g)=N2(g)+2H2O(l)+CO2 (g)△H=-898.1kJ•mol -1
盖斯定律计算①+③-2×②得到 CH4(g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=-867kJ•mol-1 ,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=-867kJ•mol-1 ;
(2)①一定条件下,发生2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0,平衡常数K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,
故答案为:$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;
②前4秒内NO浓度变化=1.00×10-3 mol/L-2.50×10-4 mol/L=7.5×10-4mol/L,NO的反应速率v(NO)=$\frac{7.5×1{0}^{-4}mol/L}{4s}$=1.875×10-4mol/(L•s),氮气的平均反应速率v(N2)=$\frac{1}{2}$v(NO)=$\frac{1.875mol/(L•s)}{2}$=9.375×10-5mol/( L•s,
故答案为:9.375×10-5mol/( L•s);
③2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0,
A.v正(NO)=2v逆(N2 )说明氮气的正逆反应速率相同,反应达到平衡状态,2v正(NO)=v逆(N2 )不能说明正逆反应速率相同,故A符合;
B.反应前后气体质量不变,气体物质的量减小,当容器中气体的平均分子量不随时间而变化说明反应达到平衡状态,故B不符合;
C.气体质量和体积不变,容器中气体的密度始终不随时间而变化,不能说明反应达到平衡状态,故C符合;
D.容器中CO的质量不再发生变化说明一氧化碳浓度不变,反应达到平衡状态,故D不符合;
E. 反应前后气体物质的量变化,当容器中气体的总压强不随时间而变化说明反应达到平衡状态,故E不符合;
故答案为:AC;
(3)①CH4燃料电池中甲烷在负极失电子发生氧化反应,该燃料电池的正极为通入氧气的电极一端,电极b为正极,在碱性环境中生成碳酸盐,结合电话守恒和原子守恒书写电极反应为:CH4+10OH--8e-=CO32-+7H2O,
故答案为:b; CH4+10OH--8e-=CO32-+7H2O;
②放电一段时间后,负极电极反应CH4+10OH--8e-=CO32-+7H2O,正极电极反应为O2+2H2O+4e-=4OH-,总化学反应的离子方程式为:CH4+2OH-+2O2→CO32-+3H2O,反应过程中消耗氢氧根离子,溶液PH减小,
故答案为:减小.
点评 本题考查了热化学方程式书写、化学反应速率计算、影响化学平衡因素分析判断、原电池原理和电极反应书写等知识,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入到 CaCl2溶液中 | |
| B. | NH3通入 AlCl3溶液中 | |
| C. | 用脱脂棉包裹Na2O2粉末向其中通入适量二氧化碳 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象或事实 | 主要原因 | |
| A | 燃煤中添加适量CaO可减少SO2排放量 | 燃烧中硫元素转化为CaSO3 |
| B | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| C | 夏天雷雨过后感觉到空气特别的清新 | 空气中O3含量增加、尘埃减少 |
| D | 蒸熟的糯米在适当条件可转化为香甜可口的甜酒 | 部分淀粉水解生成葡萄糖与乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y间可形成离子化合物 | |
| B. | 单质熔点:Y>W>X | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | Y、W形成的单核离子均能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C20H30O2、C22H30O2 | B. | C22H32O2、C20H30O2 | ||
| C. | C22H30O2、C20H30O2 | D. | C20H30O2、C22H32O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性 | |
| B. | 乙中含有化合价为-1的元素 | |
| C. | 丙与氧气的摩尔质量相同,则丙可以是CH3OH | |
| D. | 若丁中含有2种元素且含有ⅣA族元素,则相同条件下丁比甲稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com