
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | 氨气的相对分子质量大于甲烷 |
分析 NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,为正四面体构型.
解答 解:NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;CH4分子中C原子采取sp3型杂化杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,C-H之间的键角相等为109°28′,故CH4为正四面体构型,故ABD错误,C正确.
故选:C.
点评 本题考查了分子空间构型的判断,难度中等,注意理解价层电子对互斥理论与杂化轨道理论.


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 4.4g乙醛分子中含有的共用电子对数为0.6NA | |
| B. | 标准状况下,11.2L二氯甲烷所含分子数为0.5NA | |
| C. | 15.6g苯中含有碳碳双键的个数为0.6NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
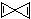 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | 分子中氢原子的化学环境只有一种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使高锰酸钾酸性溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

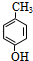 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$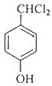 +2HCl,该反应类型为取代反应.
+2HCl,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ④ | C. | ②⑤ | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com