
【题目】2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地用煤制乙醇的过程表示如下。

(1)Cu(NO3)2是制备“催化剂X”的重要试剂。

①气体A是_________。
②实验室中用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用: ________。
③NaClO溶液吸收气体A的离子方程式是_________。
(2)过程a包括以下3个主要反应:
I.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) △H1
C2H5OH(g)+CH3OH(g) △H1
II.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) △H2
CH3COOC2H5(g)+CH3OH(g) △H2
III.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) △H3
CH3CHO(g)+CH3OH(g) △H3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇的选择性= ![]() )如下图所示。
)如下图所示。

①已知:△H1<0。随温度降低,反应I化学平衡常数的变化趋势是________。
②下列说法不合理的是_______。
A.温度可影响反应的选择性
B.225℃~235℃,反应I处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③为防止“反应III”发生,反应温度应控制的范围是____________。
④在185℃,上述反应中CH3COOCH3起始物质的量为5mol,生成乙醇的物质的量是____。
【答案】 NO Cu2++2H2O![]() Cu(OH)2+2H+,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制Cu(NO3)2的水解 2OH-+3C1O-+2NO=2NO3-+3Cl-+H2O 增大 B <205℃ 0.2mol
Cu(OH)2+2H+,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制Cu(NO3)2的水解 2OH-+3C1O-+2NO=2NO3-+3Cl-+H2O 增大 B <205℃ 0.2mol
【解析】(1)①铜和稀硝酸反应生成硝酸铜、一氧化氮和水,所以气体A是一氧化氮;正确答案:NO。
②硝酸铜为强酸弱碱盐,水解显酸性,离子方程式:Cu2++2H2O![]() Cu(OH)2+2H+,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制Cu(NO3)2的水解;正确答案:Cu2++2H2O
Cu(OH)2+2H+,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制Cu(NO3)2的水解;正确答案:Cu2++2H2O![]() Cu(OH)2+2H+,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制Cu(NO3)2的水解。
Cu(OH)2+2H+,加入硝酸,使c(H+)增大,平衡逆向移动,从而抑制Cu(NO3)2的水解。
③NaClO溶液具有强氧化性,能够把一氧化氮氧化为硝酸根离子,NaClO中+1价的氯被还原为氯离子,离子方程式是2OH-+3C1O-+2NO=2NO3-+3Cl-+H2O;正确答案:2OH-+3C1O-+2NO=2NO3-+3Cl-+H2O。
(2)①CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) △H1<0,平衡常数K=c(C2H5OH)×c(CH3OH)/c(CH3COOCH3)×c2(H2),随着温度的降低,平衡右移,生成物浓度增大,反应物浓度减小,反应I化学平衡常数增大;正确答案:增大。
C2H5OH(g)+CH3OH(g) △H1<0,平衡常数K=c(C2H5OH)×c(CH3OH)/c(CH3COOCH3)×c2(H2),随着温度的降低,平衡右移,生成物浓度增大,反应物浓度减小,反应I化学平衡常数增大;正确答案:增大。
②根据图像2可知,不同温度下,发生反应的不同,因此温度可影响反应的选择性,A正确;225℃~235℃,乙酸乙酯的选择性逐渐降低,说明反应仍在进行,反应II仍在进行,反应I就不能处于平衡状态,B错误;根据反应CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g)和CH3COOCH3(g)+H2(g)
C2H5OH(g)+CH3OH(g)和CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g)可知,增大H2的浓度,平衡右移,CH3COOCH3的转化率均增大,C正确;正确选项B。
CH3CHO(g)+CH3OH(g)可知,增大H2的浓度,平衡右移,CH3COOCH3的转化率均增大,C正确;正确选项B。
③当反应温度控制在205℃时,乙醇和乙酸乙酯的选择性之和为100%.没有反应III发生,温度大于205℃时,乙醇和乙酸乙酯的选择性之和小于100%,反应III已经发生;所以为防止反应III发生,反应温度应控制<205℃范围内;正确答案:<205℃。
④根据图像1可知,在185℃,CH3COOCH3的转化率为20%,CH3COOCH3起始物质的量为5mol,所以参加反应的CH3COOCH3的量为20%×5=1mol,生成的乙醇要有一部分进行反应II,所以根据图像2可知,在185℃,乙醇的选择性为20%,所以上述反应中最终生成乙醇的物质的量是1×20%=0.2mol;正确答案:0.2mol。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 mol氩气在标准状况下的体积约为11.2 L
B. 20 ℃、10 MPa状态下,32 g O2和O3的混合气体所含原子数为2.5NA
C. 标准状况下,11.2 L H2CO3含有的原子数为3NA
D. 常温常压下,44 g CO2含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
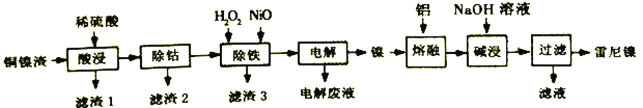
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:

下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验现象所得出的结论中,正确的是( )
A. 无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32-
B. 某物质焰色反应呈黄色,结论:该物质是钠盐
C. 无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3
D. 无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A. 5 B. 4 C. 3 D. 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
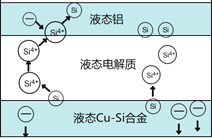
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com