
【题目】下列说法正确的是( )
A. 石油的催化重整可以得到芳香烃,说明石油中含有芳香烃
B. 煤的干馏和石油裂解得到的产物相同
C. 石油分馏得到的产物可用来萃取溴水中的溴
D. 聚丙烯塑料的结构简式为![]()
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
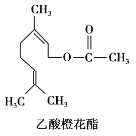
①属于芳香族化合物 ②不能发生银镜反应
③分子式为C12H20O2 ④它的同分异构体中可能有酚类
⑤1 mol该有机物水解时只能消耗1molNaOH
A. ②③④B. ②③⑤C. ①②③D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别用0.1 mol·L-1溶液进行下列实验,结论不正确的是
A. 向NaHCO3溶液中通CO2至pH=7:c(Na+) = c(HCO3-) +2c(CO32-)
B. 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl![]() )
)
C. 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13
D. 向氨水中加入少量NH4Cl固体:![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示是A、B、C、D、E四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的E |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式:_______________。
(2)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)B在加热时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,其化学方程式为___________。
(4)D的结构简式是____________。
(5)如图所示,该实验装置可用于C和D反应制取E。
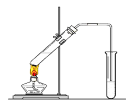
试回答下列问题:
①在右试管中通常加入__________溶液,其作用为___________;
②实验生成E的反应方程式为____________,分离右试管中所得E的操作为__________(填操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述不正确的是( )
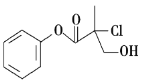
A. 有机物A属于芳香族化合物
B. 有机物A和NaOH的醇溶液共热可发生消去反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗 3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解是一种非常强有力的促进氧化还原反应的手段,许多很难进行的氧化还原反应,都可以通过电解来实现。
(1)工业上常以石墨做电极,电解NaCl水溶液时,阴极区产物有____,其溶液可用于吸收工业尾气中的SO2,写出反应的化学方程式_____。
(2)电解NaCl水溶液时,用盐酸控制阳极区溶液的pH在2~3,用平衡移动原理解释盐酸的作用_____。离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上发生电镀,有铝产生。
(3)铝原子的核外电子排布式是____,其中有____种不同能级的电子。
(4)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当所得还原产物为6g时,转移电子的物质的量为___mol。
(5)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____(填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,不能说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
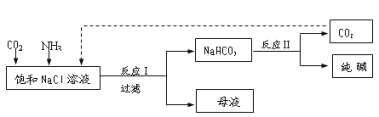
已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为______。
(2)处理母液的两种方法:
①向母液中加入石灰乳,反应的化学方程式为____,目的是使____循环利用。
②向母液中____并降温,可得到NH4Cl晶体。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
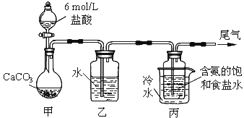
(3)装置丙中冷水的作用是______;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、洗涤、灼烧。
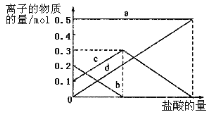
(4)若灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。曲线c对应的溶液中的离子是____(填离子符号);该样品中NaHCO3和Na2CO3的物质的量分别是___mol、___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列 离子组在对应的溶液中一定能大量共存的是
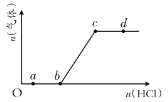
A.a点对应的溶液中:Fe3+、AlO2-、SO42-、NO3-
B.b 点对应的溶液中:K+、Ca2+、I-、Cl-
C.c 点对应的溶液中:Na+、Ca2+、NO3-、Ag+
D.d 点对应的溶液中:F-、NO3-、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验装置或操作的说法中,正确的是( )
A.图①实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2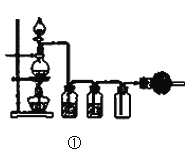
B.图②实验中若左边棉球变为橙色,右边棉球变为蓝色,则能证明非金属性:Cl>Br>I
C.图③实验中试管内的溶液中会生成血红色沉淀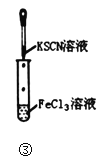
D.图④操作中可用酒精提取溴水中的溴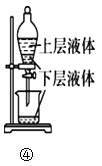
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com