
科目:高中化学 来源: 题型:填空题
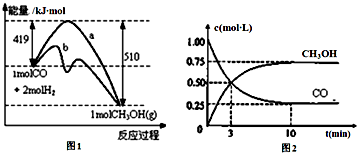 工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol
工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和铁 | B. | 镁和铜 | C. | 铝和镁 | D. | 锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O-+CO32-═H2CO3+2HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
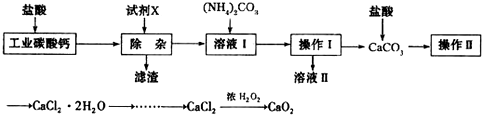
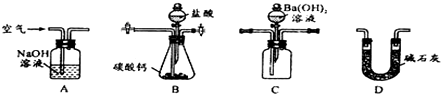
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
.如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com