
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 同浓度的AOH溶液和H2B溶液,电离程度前者大于后者 | |
| B. | HB-的电离程度大于HB-的水解程度 | |
| C. | 该盐的电离方程式为AHB═A++H++B2- | |
| D. | 在溶液中离子浓度大小顺序一般为.c(A+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
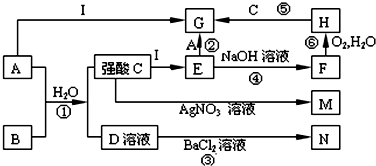
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时,应将蒸发皿中的溶液全部加热蒸干后停止加热 | |
| B. | 蒸馏实验开始时先通入冷凝水,再点燃酒精灯加热 | |
| C. | 萃取时,应选择有机萃取剂,且萃取剂的密度必须比水的密度小 | |
| D. | 分液时,分液漏斗中下层液体从下口放出,上层液体也从下口流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
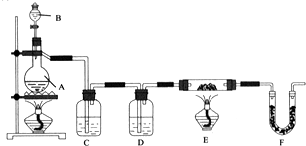
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于4.48L | B. | 小于2.24L | C. | 大于2.24L | D. | 等于2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
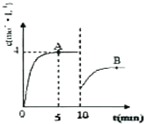 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
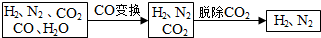
| Na2CO3 | K2CO3 | |
| 20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
| 碱的价格(元/kg) | 1.25 | 9.80 |
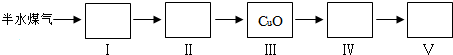
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com