
| A. | KCl═K++Cl- | B. | NH3•H2O?NH4++OH- | ||
| C. | CH3COOH═CH3COO-+H+ | D. | HCl═H++Cl- |
分析 分清电解质的强弱,强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答.
解答 解:A.KCl为强电解质,完全电离,电离方程式为KCl=K++Cl-,故A正确;
B.NH3•H2O为弱电解质,部分电离,电离方程式为NH3•H2O?NH4++OH-,故B正确;
C.CH3COOH为弱电解质,部分电离,电离方程式为CH3COOH?CH3COO-+H+,故C错误;
D.HCl为强电解质,完全电离,电离方程式为HCl═H++Cl-,故D正确;
故选C.
点评 本题主要考查学生电离方程式的书写知识,明确电解质的强弱是解题关键,注意原子团不能拆,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 将1.0 mol氮气、3.0 mol氢气,置于1 L密闭容器中发生反应,放出的热量为 92.4 kJ | |
| B. | 平衡状态由A变到B时,平衡常数K (A)<K (B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| D. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
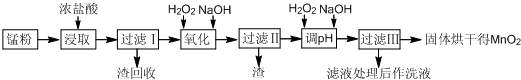
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
 ,违背了泡利原理.
,违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )
)| A. | ②④⑤⑦ | B. | ①④⑥⑧ | C. | ②③⑤⑧ | D. | ①③⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Co(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压强对该反应的平衡移动没有影响 | |
| B. | 在平衡体系中加入C,混合气体平均分子量增大 | |
| C. | 若正反应为吸热反应,则A为非气态 | |
| D. | 若正反应为放热反应,则A为非气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com