
【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
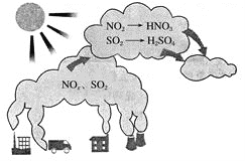
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
【答案】BD SO2+H2O![]() H2SO3、2H2SO3+O2=2H2SO4 变小 Cl2+2H2O+SO2=H2SO4+2HCl(或H2SO3+Cl2+H2O=H2SO4+2HCl) C
H2SO3、2H2SO3+O2=2H2SO4 变小 Cl2+2H2O+SO2=H2SO4+2HCl(或H2SO3+Cl2+H2O=H2SO4+2HCl) C
【解析】
(1)酸雨是指pH小于5.6的雨水,酸雨分为硫酸型酸雨和硝酸型酸雨,分别是由SO2和NOx引起,而N2和CO2是空气组成成分,不能引起酸雨,故选项BD正确;答案选BD;
(2)①空气中SO2与水生成H2SO3,NOx的氧化物与水生成HNO3,酸雨放置一段时间后,H2SO3被空气中的氧气氧化成H2SO4,酸性增强,其反应方程式为SO2+H2O![]() H2SO3、2H2SO3+O2=2H2SO4;
H2SO3、2H2SO3+O2=2H2SO4;
②自来水常用Cl2消毒,用上述雨水与自来水混合,SO2与Cl2反应:Cl2+2H2O+SO2=H2SO4+2HCl或H2SO3+Cl2+H2O=H2SO4+2HCl,因此溶液的pH将变小;
(3)①要减少酸雨的产生,需减少SO2的排放,大气中SO2来源主要是化石燃料的燃烧以及含硫矿石的冶炼和硫酸、造纸等生产过程中产生的尾气,煤中含有硫,燃烧过程中生成大量SO2,因此少用煤作燃料或对燃料进行脱硫处理,是减少酸雨的有效措施,故①符合题意;
②把烟囱造高,不能减少酸雨的生成,故②不符合题意;
③燃料脱硫,是减少酸雨的有效措施,故③符合题意;
④在已酸化的土壤中加石灰是为了中和酸,不是为了减少酸雨,故④不符合题意;
⑤开发新能源能从根本上杜绝SO2的产生,故⑤符合题意;
综上所述选项C正确;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用铂电极电解100mLHNO3 与AgNO3 的混合液,通电一段时间后,两极均收集到4.48L气体(标准状况),则原混合液中Ag+的物质的量浓度为( )
A. 1mol·L-1B. 2mol·L-1C. 2.5mol·L-1D. 4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的钠、镁、铝与足量盐酸反应时放出氢气的体积比为__________。相同质量的钠、镁、铝与足量盐酸反应时放出氢气的体积比是_________。分别为0.3 mol的钠、镁、铝投入100 mL 1 mol·L-1的硫酸溶液中,三者产生的体积比是______________。
(2)在一个用铝制的易拉罐内充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起来。
罐壁内凹而瘪的原因是______________________,离子方程式可能为____________________________;
罐再鼓起的原因是___________________________,离子方程式可能为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.NaH与H2O反应生成氢气,每生成0.6g氢气转移电子数为0.6NA
B.12g镁在空气中充分燃烧,电子转移数目为NA
C.0.1 mol熔融NaHSO4中含有阳离子数目为0.1NA
D.标准状况下,6.72 L O2和N2的混合气体含有的原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-═NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质(甲)能使上述还原过程发生。则下列说法中正确的是( )
A.物质甲可能是KMnO4
B.反应中只体现了硝酸的强氧化性
C.氧化过程的反应式一定为Cu2O-2e-+2H+═2Cu2++H2O
D.反应中若产生3.0 g气体,则转移电子数约为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ge、Na及其化合物在航空航天、电子工业上有重要应用。请回答下列问题:
(1)基态Ge原子价层电子的排布式为___,其电子填充的最高能级的轨道数为___。电子占据最高能级的电子云轮廓图为___形。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是___。
(3)硼氢化钠(NaBH4)是有机化学中的一种常用还原剂,[BH4]-的空间构型是__,中心原子的杂化形式为___。NaBH4中存在___(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)NaC1是离子晶体,其晶格能可通过下图的循环计算得到。
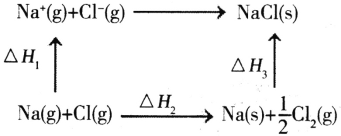
△H(晶格能)=___。
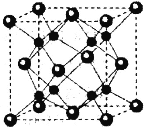
(5)Na2O的立方晶胞如图所示,氧离子采取面心立方堆积,钠离子填在由氧离子形成的__空隙中。已知晶胞边长a=0.566nm,晶胞中O原子的配位数为__;该晶体的密度是___g·cm-3(列出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com