
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.(6分)把0.4 mol X气体和0.6mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol·(L·min)-1。试计算:前2min内用X的浓度变化表示的平均反应速率为 ;2 min末时Y的浓度为 ;化学方程式中n的值是________。
Ⅱ.(8分)将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(用含a、V的的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水 g。
(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O)
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏省无锡市第一中学高一下学期期中考试化学试卷 (带解析) 题型:计算题
Ⅰ.(6分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为 ;2 min末时Y的浓度为 ;化学方程式中n的值是________。
Ⅱ.(8分)将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(用含a、V的的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水 g。
(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O)
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏省无锡市高一下学期期中考试化学试卷(解析版) 题型:计算题
Ⅰ.(6分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为 ;2 min末时Y的浓度为 ;化学方程式中n的值是________。
Ⅱ.(8分)将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(用含a、V的的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水 g。
(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:

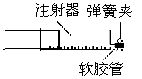
(1)如图是一支规格为50 mL的注射器(活塞与针筒间的润滑性良好),拔出针头,加入48 mg铜片,然后在安针头处套上软胶管。
(2)先抽取10 mol·L-1的稀HNO3,并立即排至废液缸中,目的是______________________。
(3)再抽取10 mL 6 mol·L-1的稀HNO3,把弹簧夹夹在软胶管上,反应开始时缓慢,后逐渐加快。预期在注射器中可观察到哪些现象?请依次写出。
(4)反应完毕后,打开止水夹,立即将活塞拉至36.2 mL处,夹好弹簧夹,观察到___________,轻摇注射器几下,静置片刻又观察到_________________________;重复以上操作几次,至针筒内最后无NO为止。针筒内溶液中c(![]() )为___________,c(H+)为___________。
)为___________,c(H+)为___________。
(5)该实验最显著的优点是_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com