
| A. | 胶体都是无色、透明的 | |
| B. | 可以通过丁达尔现象鉴别胶体和溶液 | |
| C. | 可以用滤纸分离淀粉和KI的混合液 | |
| D. | 胶粒在电场作用下均会产生电泳现象 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
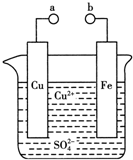
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu | |
| C. | a和b用导线相连时,电能转变为化学能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125mol | B. | 0.375mol | C. | 0.5mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
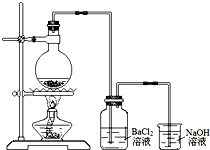 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
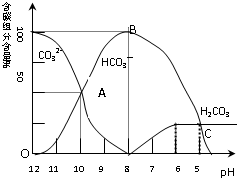 常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:
常温下在20mL0.1mol/L碳酸钠溶液中逐滴加入0.1mol/L盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒的百分含量也发生变化(二氧化碳因为逸出未画出).据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com