
分析 (1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),据此计算;
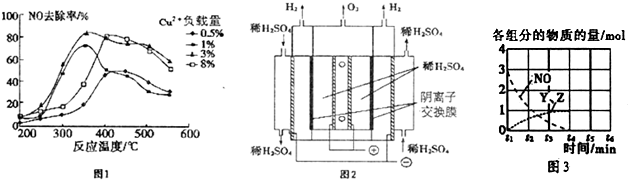
(2)根据图象找出NO去除率最高时对应的温度和催化剂中Cu2+负载量;
(3)①O3氧化NO结合水洗可产生HNO3和O2,结合原子守恒和得失电子守恒写出反应方程式;
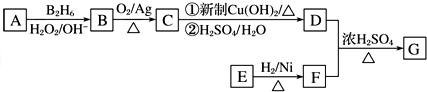
②酸性条件下,水在阳极失电子生成臭氧;
③臭氧发生装置工作一段时间后,阳极区产生氢离子,硫酸根离子向阳极移动;
(4)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;
②根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算;
(5)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图象可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物.
解答 解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJ•mol-1-2×(+180kJ•mol-1)=-1250.3 kJ•mol-1;
故答案为:-1250.3 kJ•mol-1;
(2)由图1可知在350℃左右,催化剂中Cu2+负载量为3%时,NO去除率最高;
故答案为:350℃左右、3%;
(3)①O3氧化NO结合水洗可产生HNO3和O2,其反应方程式为:3O3+2NO+H2O═2HNO3+3O2;
故答案为:3O3+2NO+H2O═2HNO3+3O2;
②酸性条件下,水在阳极失电子生成臭氧,生成1mol臭氧转移6mol电子,则电极方程式为:3H2O-6e-═O3↑+6H+或6OH--6e-=O3↑+3H2O;
故答案为:3H2O-6e-═O3↑+6H+或6OH--6e-=O3↑+3H2O;
③臭氧发生装置工作一段时间后,阳极区产生氢离子,硫酸根离子向阳极移动,所以阳极区硫酸的浓度增大,故答案为:增大;
(4)①由图3可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;
故答案为:N2;
②氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.5mol O2得到2mol电子,则NO转化为N2得到的电子为4mol,所以NO的物质的量为2mol,其体积为44.8L;
故答案为:44.8L;
(5)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2;
故答案为:N2O、NO2.
点评 本题考查了盖斯定律的应用、化学方程式的书写、电解原理的应用、氧化还原反应、图象的分析与应用等,考查了学生的分析能力以及对基础知识的综合应用能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 二者等物质的量完全燃烧消耗等量的氧气 | |
| B. | 二者分子所有原子都处于同一个平面上 | |
| C. | 二者能相互转化且反应属于可逆反应 | |
| D. | 二者可用酸性高锰酸钾溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
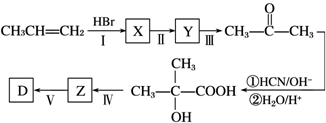
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T2时,NO2的平衡转化率为70.0% | |
| B. | 该反应的△H>0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
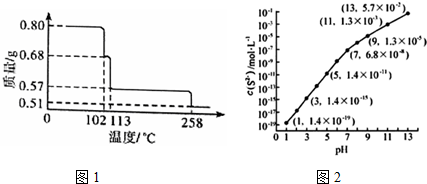
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO${\;}_{2}^{-}$,则与过量NH3•H2O也生成AlO${\;}_{2}^{-}$ | |
| B. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
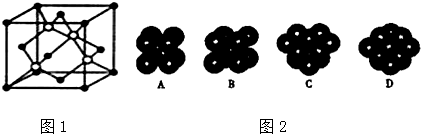
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
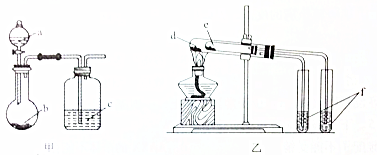
| 选项 | 实验试剂 | 实验结论 | ||
| A | a.稀硫酸 | b.碳酸氢钠 | c.硅酸钠溶液 | 酸性:硫酸>碳酸>硅酸 |
| B | a.稀盐酸 | b.二氧化锰 | c.溴化钠溶液 | 氧化性:MnO2>Cl2>Br2 |
| C | d.小苏打 | e.苏打 | f.石灰水 | 热稳定性:苏打>小苏打 |
| D | d.氯化钠 | e.氯化铵 | f.硝酸银溶液 | 沸点:氯化钠>氯化铵 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:填空题
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液 |
② | 20mL 0.2mol·L﹣ | 30mL 0.01mol·L﹣1KMnO4溶液[来 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
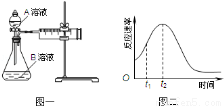
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com