
| A. | 12.8g | B. | 9.6g | C. | 6.4g | D. | 3.2g |
分析 铜、锌与硝酸反应生成硝酸铜、硝酸锌与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,氮的氧化物与氧气、水反应生成硝酸金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.
解答 解:铜与硝酸反应生成硝酸铜与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,铜提供的电子等于氧气获得的电子,
标准状况下1.12L氧气的物质的量n(O2)=$\frac{V({O}_{2})}{Vm}$=$\frac{3.92L}{22.4L/mol}$=0.175mol,
转移电子n(e-)=4×0.175mol=0.7mol,
设Cu的物质的量xmol,Zn的物质的量为ymol
$\left\{\begin{array}{l}{64x+65y=22.6}\\{2x+2y=0.7}\end{array}\right.$
所以$\left\{\begin{array}{l}{x=0.15}\\{y=0.2}\end{array}\right.$
m(Cu)=n(Cu)•M(Cu)=0.15mol×64g/mol=9.6g,
故选B.
点评 本题考查氧化还原反应的有关计算,难度中等,根据反应过程判断铜通过的电子等于氧气获得的电子是关键,转移氧化还原反应中守恒思想的运用.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 合成有机高分子化合物称聚合物或高聚物,是因为它们大部分是由小分子通过加聚反应制得的 | |
| B. | 有机高分子化合物的相对分子质量很大,因而其结构复杂 | |
| C. | 对于一块高分子材料,n是一个整数值,因而它的相对分子质量是确定的 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 温度(℃) | CaCO3的状态 | 盐酸浓度(mol/L) |
| A | 20 | 块状 | 3 |
| B | 30 | 小颗粒 | 2 |
| C | 30 | 块状 | 4 |
| D | 30 | 小颗粒 | 4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g 12C的物质的量为2mol | |
| B. | H2的相对分子质量为4 | |
| C. | 1mol水所含的分子数约为3.01×1023 | |
| D. | 56g铁所含的原子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C为三种烃的含氧衍生物.它们有如下的转化关系(部分产物及反应条件已略去):其中A 的分子式是C5H10O2,C可氧化为醛,则A的结构有( )
A、B、C为三种烃的含氧衍生物.它们有如下的转化关系(部分产物及反应条件已略去):其中A 的分子式是C5H10O2,C可氧化为醛,则A的结构有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
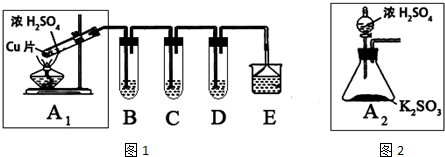
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 | 若品红褪色(或有气泡),, 则“吸收液”中存在 SO32-. |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 | 若出现白色沉淀(或品红溶液褪色,或有气泡), 则“吸收液”中存在 HSO3-. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
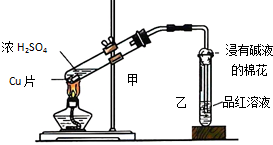 实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题:
实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com