
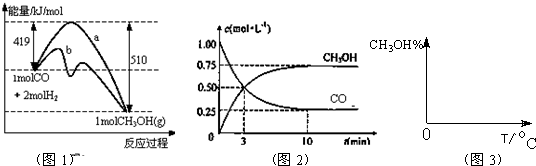
¹¤ŅµÉĻÓĆCOÉś²śČ¼ĮĻ¼×“¼”£Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ
CO(g)+2H2(g)![]() CH3OH(g)ӣ
CH3OH(g)ӣ

£Ø1£©øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ĪŖ£ŗK=
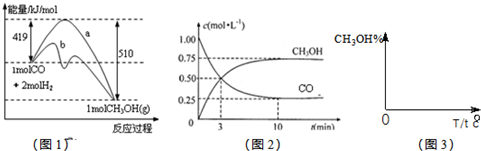
£Ø2£©Ķ¼1ŹĒ·“Ó¦Ź±COŗĶCH3OH(g)µÄÅضČĖꏱ¼äµÄ±ä»ÆĒéæö”£“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ÓĆCOÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(CO£©= ”£
£Ø3£©ŹŹŅĖµÄ“߻ƼĮÄÜ £ØŃ”ĢīŠņŗÅ£©”£
a.øı䷓ӦµÄČČŠ§Ó¦ b.½µµĶÉś²śÄÜŗÄ c.¼Óæģ·“Ó¦ĖŁĀŹ
d.Ģįøß·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ
£Ø4£©ŌŚ2 LĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦ CO(g)+2H2(g) ![]() CH3OH(g) ČōT”ꏱ£¬¼ÓČė2mol CH3OH£¬·“Ó¦“ļĘ½ŗāŗó£¬Éś³ÉCO 1 mol£¬“ĖŹ±ĻņČŻĘ÷ÖŠĶ¬Ź±¼ÓČė2 molµÄCH3OHŗĶ4molµÄH2»ģŗĻĘųĢå£Ø±£³ÖĪĀ¶Č²»±ä£©£¬ŌņĘ½ŗā½« £ØĢī”°ĻņÕż·“Ó¦·½Ļņ”±”¢”°ĻņÄę·“Ó¦·½Ļņ”±»ņ”°²»”±£©ŅĘ¶Æ£¬“ļµ½ŠĀĘ½ŗāŗóĘ½ŗā³£ŹżKµÄÖµĪŖ
CH3OH(g) ČōT”ꏱ£¬¼ÓČė2mol CH3OH£¬·“Ó¦“ļĘ½ŗāŗó£¬Éś³ÉCO 1 mol£¬“ĖŹ±ĻņČŻĘ÷ÖŠĶ¬Ź±¼ÓČė2 molµÄCH3OHŗĶ4molµÄH2»ģŗĻĘųĢå£Ø±£³ÖĪĀ¶Č²»±ä£©£¬ŌņĘ½ŗā½« £ØĢī”°ĻņÕż·“Ó¦·½Ļņ”±”¢”°ĻņÄę·“Ó¦·½Ļņ”±»ņ”°²»”±£©ŅĘ¶Æ£¬“ļµ½ŠĀĘ½ŗāŗóĘ½ŗā³£ŹżKµÄÖµĪŖ
£Ø5£©ŗćČŻĢõ¼žĻĀ£¬ĻĀĮŠ“ėŹ©ÖŠÄÜŹ¹n (CH3OH)/n (CO)Ōö“óµÄÓŠ £ØŃ”ĢīŠņŗÅ£©”£
a. ÉżøßĪĀ¶Č b. Ź¹ÓĆ“ß»Æ¼Į c.ŌŁ³äČė2mol H2 d.ŌŁ³äČė1mol CO
£Ø6£©¼×“¼æÉÓėŃõĘų¹¹³ÉČ¼ĮĻµē³Ų£¬øƵē³ŲÓƶąæ׵ĶčŠŌµē¼«½žČėÅØĒāŃõ»Æ¼ŲČÜŅŗ£¬Š“³öøƵē³ŲµÄøŗ¼«·“Ó¦Ź½___________________

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

| c(CH3OH) |
| c(CO)”Įc2(H2) |
| c(CH3OH) |
| c(CO)”Įc2(H2) |
| n(CH3OH) |
| n(CO) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
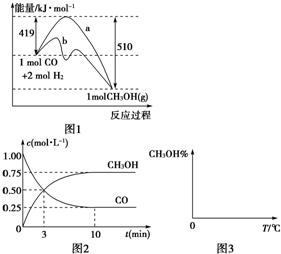 ¹¤ŅµÉĻÓĆCOÉś²śČ¼ĮĻ¼×“¼£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©£®Ķ¼1±ķŹ¾·“Ó¦ÖŠÄÜĮæµÄ±ä»Æ£»Ķ¼2±ķŹ¾Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė4mol H2ŗĶŅ»¶ØĮæµÄCOŗó£¬COŗĶCH3OH£Øg£©µÄÅضČĖꏱ¼ä±ä»Æ£®
¹¤ŅµÉĻÓĆCOÉś²śČ¼ĮĻ¼×“¼£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©£®Ķ¼1±ķŹ¾·“Ó¦ÖŠÄÜĮæµÄ±ä»Æ£»Ķ¼2±ķŹ¾Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė4mol H2ŗĶŅ»¶ØĮæµÄCOŗó£¬COŗĶCH3OH£Øg£©µÄÅضČĖꏱ¼ä±ä»Æ£®| 3 | 2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com