
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。 ②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了下列实验装置,进行实验。


请回答下列问题:
(1)①仪器a的名称____________。
②饱和食盐水的作用是____________。
③该兴趣小组用100mL 12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______________g。(写计算过程)
(2)小组成员向含Ca(OH)20.25 mol的石灰乳中以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中![]() =______________。
=______________。
【答案】(1)①分液漏斗(2分)②除去氯气中混有的氯化氢 (2分) ③7.15 (4分) (2)7:6 (2分)
【解析】
试题分析:(1)①仪器a的名称是分液漏斗;
②浓盐酸具有挥发性,制得的C12中混有HCl,HCl极易溶于水,为了减少C12的溶解,用饱和食盐水除去。
③根据方程式:4HCl (浓)+MnO 2![]() MnCl2 +C12↑+2H2O,100mL12mol/L盐酸与8.7g MnO2反应,盐酸过量,用二氧化锰计算可得V(Cl2)=2.24L;再根据反应:2Cl2 +2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O可得生成m[Ca(ClO)2]=0.05mol×143g/mol=7.15g。
MnCl2 +C12↑+2H2O,100mL12mol/L盐酸与8.7g MnO2反应,盐酸过量,用二氧化锰计算可得V(Cl2)=2.24L;再根据反应:2Cl2 +2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O可得生成m[Ca(ClO)2]=0.05mol×143g/mol=7.15g。
(2)根据氧化还原反应中得失电子数相等,生成氯离子得到电子和生成次氯酸根和氯酸根失去的电子守恒,设n(ClO-)=xmol,n(ClO3-)=ymol;则得到:0.37=x×1+y×5;根据钙离子守恒可知0.5x+0.5y+0.37×0.5=0.25,解得:x=0.07,y=0.06,则产物中n(ClO)/n(ClO3)=7:6。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N﹣N吸收167 kJ热量,生成1mol N≡N放出942 kJ。根据以上信息和数据,下列说法正确的是( )
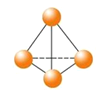
A.N4与N2互为同分异构体
B.1mo1N4气体转变为N2将吸收882 kJ热量
C.N4(g)═ 2N2(g) ΔH = - 882KJ
D.P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较或归纳一定正确的是( )
A. 离子半径:阴离子>阳离子 B. 酸性:HClO4>H2SO4
C. 熔沸点:共价化合物>离子化合物 D. 稳定性:PH3>NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对阿司匹林的描述错误的是
A.化学名为乙酰水杨酸 B.是一种难溶于水的白色晶体
C.长期大量服用会出现不良反应 D.是一种重要的抗生素即消炎药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案设计中,可行的是
A.用萃取的方法可将汽油和煤油进行分离
B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉
C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物
D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,把浓度相同的醋酸和氢氧化钠混合后,得到的溶液中,水溶液的KW值为( )
A. 大于1×10-14 B. 小于1×10-14 C. 等于1×10-14 D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com