
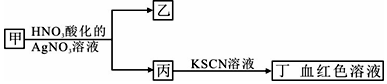
| A. | 若乙为白色沉淀,则甲中可能含有SiO32- | |
| B. | 若乙为淡黄色沉淀,则甲中可能含有FeBr3 | |
| C. | 若乙为淡黄色沉淀,则甲中可能含有S2- | |
| D. | 若乙为白色沉淀,则甲中一定含有FeCl3 |
分析 A.白色沉淀不能为硅酸;
B.乙可能为AgBr,由丁可知丙中含铁离子;
C.FeS不溶于水,溶液中不存在Fe2S3;
D.乙为白色沉淀,可能为AgCl,但甲可能为FeCl2,以此来解答.
解答 解:A.硅酸根离子与亚铁离子、铁离子不能共存,则甲中不能含有SiO32-,故A错误;
B.乙可能为AgBr,由丁可知丙中含铁离子,则甲中可能含有FeBr3,故B正确;
C.FeS不溶于水,溶液中不存在Fe2S3,则甲中不可能含有S2-,故C错误;
D.乙为白色沉淀,可能为AgCl,但甲可能为FeCl2,也可能含FeCl3,或二者均有,故D错误;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握离子之间的反应、铁离子的检验、沉淀的判断为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的应用,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向含有氯化铁杂质的氯化铜溶液中加入铜 | 除去氯化铁杂质 |
| B | 向某溶液中加入盐酸话的氯化钡溶液 | 效验SO${\;}_{4}^{2-}$的存在 |
| C | 常温下,用pH计测定NaHCO3溶液的pH | 比较HCO${\;}_{3}^{-}$水解、电离程度的相对大小 |
| D | 将SO2通入Ba(NO3)2溶液中 | 证明BaSO3不溶于水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验→分类(预测Br2的化学性质)→观察(得出Br2的物理性质)→比较并得出结论 | |
| B. | 分类(预测Br2的化学性质)→观察(得出Br2的物理性质)→实验→比较并得出结论 | |
| C. | 观察(得出Br2的物理性质)→实验→分类(预测Br2的化学性质)→比较并得出结论 | |
| D. | 观察(得出Br2的物理性质)→分类(预测Br2的化学性质)→实验→比较并得出结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥③⑤① | B. | ①②③⑤ | C. | ④⑥③① | D. | ④③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
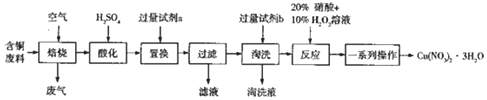
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ρ=$\frac{(36.5V+22400)c}{V}$ | B. | c=$\frac{1000Vρ}{36.5V+22400}$ | ||
| C. | V=$\frac{22400ω}{36.5(1-ω)}$ | D. | ρ=$\frac{36.5c}{1000ω}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AlCl3 | B. | NaHCO3 | C. | Na2CO3 | D. | Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
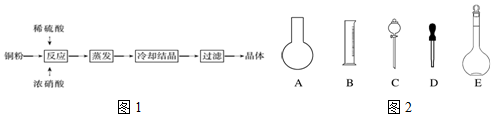
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com