
【题目】有下列五组物质:A、 O2和O3 B 、![]() Cl和
Cl和![]() Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与
Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与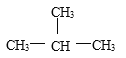 E、
E、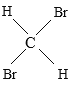 与
与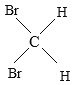
(1)______组两种物质互为同位素;
(2)______组两种物质互为同素异形体;
(3)______组两种物质互为同系物;
(4)______组两种物质互为同分异构体;
(5)______组两种物质实为同一物质。
【答案】B A C D E
【解析】
(1)质子数相同中子数不同的原子互称同位素;
(2)同种元素形成的不同单质互为同素异形体;
(3)结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
(4)分子式相同,结构不同的化合物互称为同分异构体;
(5)同种物质指组成和结构都相同的物质.
(1)35Cl和37Cl是氯元素的不同原子,互为同位素,故选B;
(2)O2和O3是氧元素组成的结构不同的单质,互为同素异形体,故选A;
(3)CH4与C7H16都属于烷烃,结构相似,相差6个CH2原子团,互为同系物,故选C;
(4)CH3CH2CH2CH3与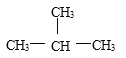 分子式相同,结构不同,为碳链异构,互为同分异构体,故选D;
分子式相同,结构不同,为碳链异构,互为同分异构体,故选D;
(5)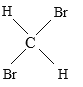 与
与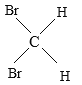 是空间四面体,结构相同,属于同一种物质,故选E.
是空间四面体,结构相同,属于同一种物质,故选E.


科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.069![]() 混合并配成溶液,向溶液中滴加0.1mol·
混合并配成溶液,向溶液中滴加0.1mol·![]() 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成![]() 的物质的量的关系的是
的物质的量的关系的是
A.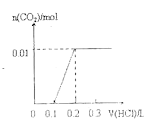 B.
B.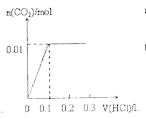
C.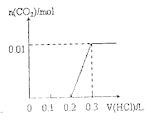 D.
D.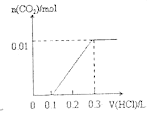
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ·mol-1
B. 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C. 在101k Pa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ·mol-1
D. 在稀溶液中,H+(aq)+OH-(aq)=H2O(l),![]() H=-57.3 kJ·mol-1。若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ
H=-57.3 kJ·mol-1。若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.ClO2 是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 ClO2:2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中还原剂的化学式是 __________;被还原元素的元素符号是 _________ ;
(2)试比较 KClO3 和 CO2 的氧化性强弱 ____________________________________;
(3)消毒时,ClO2 还可以将水中的 Fe2+ 、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,此过程说明 ClO2 具有 ___________ ( 填“氧化”或“还原” ) 性;
(4)当转移 0.2mol 电子时,生成的ClO2在标准状况下的体积为 ___________________。
Ⅱ.根据已学知识回答下列问题:
(1)在反应 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为________。
(2)2FeS+ 6H2SO4(浓)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
(3)配平下面两个反应:
① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL FeBr2溶液中逐渐通入Cl2,其中n(Fe 3+)、n(Br2) 随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
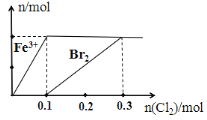
A.氧化性强弱:Br2 > Fe3+
B.由图可知,该FeBr2溶液的浓度为1 mol·L-l
C.n(Cl2)=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如图所示。
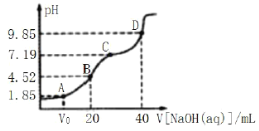
下列说法不正确的是
A. 点A所得溶液中:Vo>10mL
B. 点B所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. 点C所得溶液中:c(Na+)>3c(HSO3-)
D. 点D所得溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com