
【题目】某课题组设计实验探究SO2的性质。
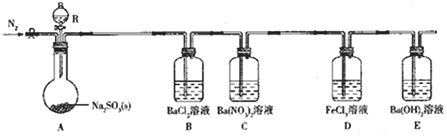
实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀。
(1)仪器R的名称是___。
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:___。
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2”的目的是___。
(4)探究装置C中通入SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2SO42-+2NO+4H+。
猜想2:通入少量的SO2,则发生反应的离子方程式为___。
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中,___ | ___ |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是___(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH___7(填“>”“<”或“=”)。
【答案】分液漏斗 Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 排尽装置内空气,避免O2干扰实验 3Ba2++3SO2+2NO3-+2H2O=3BaSO4↓+4H++2NO 加入铜粉(或BaCl2溶液) 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 c <
【解析】
分析装置中实验现象可知:B中无沉淀生成生成气体中无三氧化硫,C中有白色沉淀证明生成的二氧化硫通入硝酸钡溶液中发生氧化还原反应,二氧化硫被氧化为硫酸,生成硫酸钡白色沉淀;D中溶液颜色变浅是二氧化硫和氯化铁反应生成氯化亚铁和硫酸,E中产生白色沉淀是二氧化硫和氢氧化钡反应生成亚硫酸钡白色沉淀,装置A中亚硫酸钠和浓硫酸反应生成二氧化硫气体,装置B是检验是否生成三氧化硫,装置C、D是验证二氧化硫的还原性,装置E是氢氧化钡吸收二氧化硫气体。
(1)仪器R是添加溶液的分液漏斗;
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,A中反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间![]() ,然后启动A中反应.“通入一段时间的N2”的目的是:排尽装置内空气,避免O2干扰实验;
,然后启动A中反应.“通入一段时间的N2”的目的是:排尽装置内空气,避免O2干扰实验;
(4)①猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O =BaSO4↓+2SO42-+2NO+4H+;
猜想2:通入少量的SO2,二氧化硫钡氧化生成的硫酸根离子全部沉淀,溶液中存在稀硝酸,则发生反应的离子方程式为:3Ba2++3SO2+2NO3-+2H2O=3BaSO4↓+4H++2NO↑;
②设计实验证明猜想1和猜想2哪个合理,取少量C中反应后溶液于试管中加入铜粉(或BaCl2溶液);若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确;
(5)检验装置D反应后溶液中是否有Fe2+的最佳试剂是c.K3[Fe(CN)6]溶液,遇到亚铁离子生成蓝色沉淀,故答案为:c;
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,M为亚硫酸钡,取适置M于试管中,滴少量盐酸,M有剩余,则盐酸和亚硫酸钡反应生成了可溶性的亚硫酸氢钡,亚硫酸氢根离子的电离程度大于基水解程度,故溶液显酸性,所得溶液的pH<7。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】过渡金属钯催化的偶联反应是近年来有机合成的热点之一,如反应①:

化合物II可由以下合成路线获得:

(1)化合物I所含官能团的名称为______________,化合物II的分子式为_____________。
(2)化合物IV的结构简式为______________________,某同学设想无需经反应②、③、④和⑤,直接用酸性KMnO4溶液就可将化合物III氧化为化合物VII,该设想明显不合理,其理由是__________________________________________________________。
(3)化合物VII有多种同分异构体,请写出一种符合下列要求的结构简式____________。
i)苯环上有两个取代基
ii)1 mol 该物质发生银镜反应能生成4 mol Ag
(4)反应⑥的化学方程式为________________________________________。(注明条件)
(5)化合物![]() 与化合物
与化合物![]() 在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式________________________________。
在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
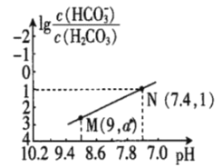
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源。
Ⅰ.已知:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-70.8 kJ·mol-1 CO(g)+2H2(g)=CH3OH(g) △H=-90.5 kJ·mol-1
写出由CH4和O2制取CH3OH(g)的热化学方程式_____________________。
Ⅱ.对于反应CO(g)+2H2(g)=CH3OH(g),回答下列问题:
(1)图1是CO(g)和CH3OH(g)物质的量浓度随时间(t)的变化曲线,从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________,CO的转化率为_________。
(2) 在容积为2L的刚性容器中充入5mol CO和10mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)的变化曲线如图2所示。

①计算B点平衡常数KB=______;达到平衡时,若再充入2mol CO、4mol H2和2mol CH3OH,反应向__________进行(填“正反应方向”或“逆反应方向”)。
②比较KA、KB的大小________。
③能判断该反应达到化学平衡状态的是____(填字母序号)。
A.H2的体积分数不再改变
B.H2的消耗速率等于CH3OH的生成速率的2倍
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的两种组成的化合物,可以发生如下图转化:
离子中的两种组成的化合物,可以发生如下图转化:
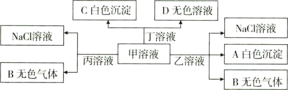
下列说法错误的是![]()
![]()
A.乙为![]()
B.能大量共存于溶液丙中的离子:![]() 、
、![]() 、
、![]()
C.甲溶液中粒子的等量关系:![]()
D.甲溶液中滴加少量丁溶液反应的离子方程式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 五种元素的原子序数依次增大,B、C 的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的氧化物既能与强酸反应,又能与强碱反应;D的原子结构示意图为: ;E的最外层电子数是电子层数的2倍。试回答下列各问题:
;E的最外层电子数是电子层数的2倍。试回答下列各问题:
(1)B、D元素分别为_________、_________;
(2)D元素位于元素周期表中第_______周期、第______族;
(3)化合物B2A的电子式____________________;
(4)E的最高价氧化物的水化物的分子式是________________________。
(5)D与NaOH溶液反应的化学方程式:_______________________________。
(6)C的氧化物与E的最高价氧化物的水化物溶液反应的离子方程式: ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,气体被还原的是
A.水蒸气使 CuSO4固体变蓝B.氯气使浅绿色 FeC12 溶液变黄
C.H2使灼热CuO 固体变红D.氨气使A1Cl3溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量FeO、Fe、Fe2O3的混合物中加入200mL1mol/L的盐酸,恰好使混合物完全溶解,并放出1.12L气体(标准状况),所得溶液经检验不含Fe3+。若用足量CO在高温下还原相同质量的此混合物,能得到铁的质量是
A.5.6gB.5.04gC.2.8gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示的转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
![]()
A.X可能为Al或Cl2
B.Y一定为NaOH(aq)
C.N一定是HCl(aq)
D.Q、Z中的一种必为Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com