
 (1)下列物质中可以作为燃料电池的负极反应物的是
(1)下列物质中可以作为燃料电池的负极反应物的是

科目:高中化学 来源: 题型:

| A、①、④ | B、③、⑤ |
| C、②、⑥ | D、②、⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na失火不能用CO2灭火,K失火也不能用CO2灭火 |
| B、Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 |
| C、将SO2通入BaCl2溶液没有白色沉淀生成,将SO2通入Ba(NO3)2溶液也没有白色沉淀生成 |
| D、工业上电解熔融MgCl2制取金属镁,也用电解熔融AlCl3的方法制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HBr、HCl、BaSO4 |
| B、NH4Cl、CH3COOH、Cu |
| C、NaOH、CO2、NH3?H2O |
| D、HClO、Na2S、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在外电路中电子由正极流向负极 |
| B、在原电池中,只有金属锌作为负极 |
| C、原电池工作时,阳离子向正极方向移动 |
| D、原电池工作时,阳离子向负极方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
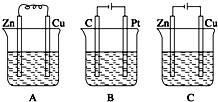 如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
A、2NaCl(s)+H2SO4(浓)
| ||||
B、C+2H2SO4(浓)
| ||||
C、Cu+2H2SO4(浓)
| ||||
D、2FeO+4H2SO4(浓)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| B | D | C | B | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| n(B) |
| n(D) |
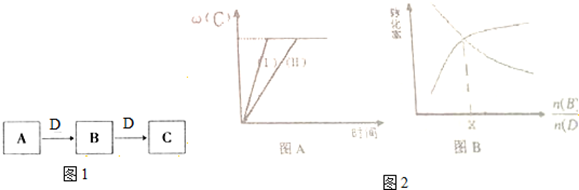
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com