
| A. | 3a+b-c | B. | c-3a-b | C. | a-b-c | D. | c-a-b |
分析 已知①C(s)+O2(g)=CO2 △H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
根据盖斯定律,①×3+②-③可得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),据此计算该反应的焓变△H.
解答 解:碳的燃烧热△H1=a kJ•mol-1,则碳燃烧的热化学方程式为:①C(s)+O2(g)=CO2 △H1=a kJ•mol-1,
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
根据盖斯定律,①×3+②-③可得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x=(a kJ•mol-1)×3+b kJ•mol-1-c kJ•mol-1=(3a+b-c)kJ•mol-1,
故选A.
点评 本题考查反应热与焓变的应用,题目难度不大,根据盖斯定律正确构造目标反应为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及灵活应用能力.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:多选题
| A. | 铜铸塑像上出现铜绿[Cu2(OH)2CO3] | |
| B. | 灶具大理石板被食醋腐蚀变得不光滑 | |
| C. | 小苏打可用于治疗胃酸过多 | |
| D. | 用煤气灶燃烧天然气为炒菜提供热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
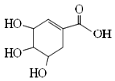
| A. | 分子式为C7H6O5 | B. | 分子中含有两种官能团 | ||
| C. | 1mol该有机物能与4molNaOH反应 | D. | 可发生加成和取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①和③ | C. | 只有② | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵和草木灰混合使用,能增强化肥的肥效 | |
| B. | 二氧化硫和漂白粉混合使用,能增强漂白效果 | |
| C. | 浓盐酸和高锰酸钾混合使用,能增强高锰酸钾的氧化性 | |
| D. | 氢氧化钠固体和氧化钙混合使用,能增加吸水能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 氢氧化钡跟硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 石灰石跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
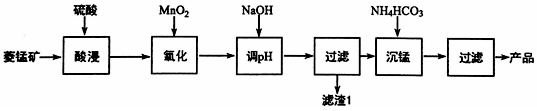
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com