
Fe2O3、ZnO、CuO的固体混合粉末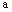 克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为 ( )
克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为 ( )
A.7.41B.3.59C.3.21D.2.46
【知识点】金属的性质,计算型选择题的方法。
【答案解析】C 解析:发生的有关反应为:
Fe2O3+3CO ==2Fe+3CO2, ZnO+CO== Zn+CO2, CuO+CO == Cu+CO2,
生成的CO2为5.00g/100g/mol==0.05mol,从反应方程式可以看出,CO2中的O原子来源于CO和金属氧化物,则氧化物中氧元素的物质的量n(O)=0.05mol,m(O)=0.05mol×16g/mol=0.8g,所以金属氧化物的质量为2.41g+0.8g=3.21g,即a=3.21,
【思路点拨】本题考查混合物的质量计算,题目难度中等,利用元素质量守恒的方法确定CO2的物质的量等于金属氧化物中氧原子的物质的量。


科目:高中化学 来源: 题型:
向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的
是 ( )
A.有铜无铁 B. 有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于阿佛加德罗常数的说法正确的是( )
A.1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA
B.一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA
C.常温下18g铝放入足量浓硫酸中转移电子数2NA
D.0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为中学常见物质, 其中A为单质,B、C、D为化合物,并且存在如下转化关系:试回答下列问题:
其中A为单质,B、C、D为化合物,并且存在如下转化关系:试回答下列问题:
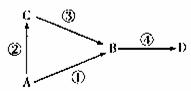
(1)若A为空气的主要成分,B与D为氧化物,试写出D对大气的一种危害 ;
(2)若A为淡黄色非金属单质,B为气态氧化物,是空气的重要污染物之一,C为气态氢化物。试写出B与C反应的化学方程式____
(3)若A为金属单质,且D为红褐色不溶性固体,则反应③的离子方程式为_ 。
(4)B与C为氧化物,D是一种盐,俗名纯碱
①若A为金属单质,写出反应④的化学方程式为 ;
②若A为非金属单质,则符合转化④的一个反应的离子方程式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g铜镁合金完全溶解于50mL密
度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下:
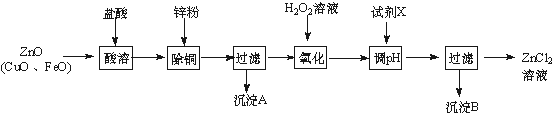
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Zn2+ | 5. 2 | 6. 4 |
| Fe2+ | 5. 8 | 8. 8 |
(1)加入H2O2溶液发生反应的离子方程式为 ▲ 。
(2)流程图中,为了降低溶液的酸度,试剂X可以是 ▲ (选填序号:a.ZnO;b.Zn(OH)2 ; c.Zn2(OH)2CO3 ;d.ZnSO4);pH应调整到 ▲ 。
(3)氯化锌能催化乳酸(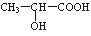 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ▲ ,聚乳酸的结构简式为 ▲ 。
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ▲ ,聚乳酸的结构简式为 ▲ 。
Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq)},然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ▲ ;阴极的电极反应为 ▲ 。
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将分别含有甲、乙两种常见金属元素的两种正盐A和B的混合物溶于水,通入氯气,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色。若在该混合物的溶液中滴加一定浓度的氨水至过量,可得到白色沉淀C。向沉淀C加入过量NaOH溶液,沉淀部分溶解,剩余白色沉淀D。将D溶于盐酸,可得到A溶液;将D灼烧可得到优质的耐高温材料。
(1)试写出A和B的化学式:A ,B 。
(2)元素乙的单质可与某黑色固体反应置换出熔融态的铁,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是(双选)( )
A.用小苏打治疗胃酸过多:HCO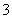 +H+===CO2↑+H2O
+H+===CO2↑+H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO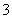 +2OH-===CaCO3↓+CO
+2OH-===CaCO3↓+CO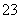 +2H2O
+2H2O
C.碳酸钠溶液与盐酸反应,有气泡逸出:Na2CO3+2H+===2Na++H2O+CO2↑
D.Na2CO3溶液中通入少量CO2:CO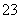 +CO2+H2O===2HCO
+CO2+H2O===2HCO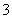
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com